Microencapsulación mediante secado por aspersión de aceite de mora (Rubus glaucus) extraido con CO2 supercrítico
Microencapsulation by spray drying of blackberry (Rubus glaucus) oil extracted with supercritical CO2
DOI:
https://doi.org/10.15446/rev.colomb.quim.v45n2.57481Palabras clave:
semilla de mora, fluidos supercríticos, microencapsulación, microscopía electrónica de barrido (es)blackberry seed, supercritical fluids, microencapsulation, scanning electron microscopy (en)
Doi: https://doi.org/10.15446/rev.colomb.quim.v45n2.57481.
Microencapsulación mediante secado por aspersión de aceite de mora (Rubus glaucus) extraído con CO2 supercrítico
Microencapsulation by spray drying of blackberry (Rubus glaucus ) oil extracted with supercritical CO2
Microencapsulação por secagem por atomização de óleo de amora (Rubus glaucus) extraído com Co2 supercrítico
Paola M. Figueroa1, Miguel A. Ceballos1, Andrés M. Hurtado2,*
1 Grupo de investigación Tecnologías Emergentes en Agroindústria (TEA) - Universidad de Nariño. Ciudad Universitaria Torobajo, Pasto - Calle 18 Cr 50, Nariño, Colombia
2 Director grupo de investigación Tecnologías Emergentes en Agroindústria - Universidad de Nariño, Facultad de Ingeniería Agroindustrial. Ciudad Universitaria Torobajo - Calle 18 Cr 50, Nariño, Colombia
* Autor para correspondencia: ahurtadob@hotmail.com
Article citation:
Figueroa, P. M.; Ceballos, M. A.; Hurtado, A. M. Microencapsulación mediante secado por aspersión de aceite de mora (Rubus glaucus) extraído con CO2 supercrítico. Rev. Colomb. Quim. 2016, 45 (2), 39-47. DOI: https://doi.org/10.15446/rev.colomb.quim.v45n2.57481.
Recibido: 17 de Mayo de 2016. Aceptado: 18 de Agosto de 2016.
Resumen
El aceite de mora es un ingrediente natural con potencial en la industria cosmética y alimentaria, puede experimentar degradación oxidativa en condiciones ambientales. Se extrajo aceite a partir de semillas de mora empleando fluidos supercríticos, se microencapsuló mediante secado por aspersión y se evaluó la influencia de diferentes condiciones de operación en el rendimiento y la eficiencia del proceso. Se emplearon como materiales encapsulantes: masterdry, goma arábiga y maltodextrina. Se comparó el perfil de ácidos grasos antes y después de la microencapsulación y se estudió el tamaño y morfología de las microcápsulas. En el proceso de microencapsulación la temperatura de entrada fue la única variable estadísticamente significativa usando masterdry y goma arábiga. La goma arábiga resultó ser el mejor encapsulante entre los tres estudiados. Se obtuvieron microcápsulas con tamaños entre 8,2 y14 |im, con superficie continua en las paredes y ausencia de poros. Se comprobó que la microencapsulación con los tres encapsulantes permitió proteger el aceite y conservar mayoritariamente su perfil de ácidos grasos.
Palabras clave: Semilla de mora, fluidos supercríticos, microencapsulación, microscopía electrónica de barrido.
Abstract
Blackberry oil is a natural ingredient with potential in cosmetics and food industry, however, it experiences oxidative degradation at ambient conditions. Therefore, oil was obtained from blackberry seeds by supercritical fluid extraction and then was microcapsulated by spray drying. The influence of different operating conditions during spray-drying towards yield and encapsulation was evaluated. Masterdry, gum arabic, and maltodextrin were used as wall materials. Fatty acid profile was compared before and after microencapsulation, the size and morphology of the microcapsules were also studied. Inlet temperature was the only statistically significant variable in process yield and efficiency when gum arabic and masterdry were used. Feed flow rate was statistically significant only for process yield and it was influenced negatively when maltodextrin was used. Gum arabic was the best wall material among the three studied. Microcapsules with sizes between 8.2 and 14 |im were obtained; continuous wall and no apparent cracks were observed. It was also seen that the fatty acid profile was mostly conserved after microencapsulation process carried out with the three wall materials.
Keywords: Blackberry seed, supercritical fluids, microencapsulation, scanning electron microscopy.
Resumo
O óleo de amora é um ingrediente natural com potencial na indústria cosmética e dos alimentos, é susceptível à degradação por oxidação em condições ambientais. O óleo de sementes de amora foi extraído usando fluidos supercríticos e foi microencapsulado por secagem por pulverização. Foi avaliada a influência de diferentes condições de operação sobre o rendimento e eficiência do processo. Foram utilizados como materiais de encapsulação: masterdry, maltodextrina, e goma arábica. O perfil dos ácidos graxos foi comparado antes e depois de microencapsulação, o tamanho e a morfologia das microcápsulas foi também estudada. Determinou-se que, no processo de microencapsulação a temperatura de entrada era a única variável estatisticamente significativa usando masterdry e goma-arábica. A goma-arábica mostrou ser o melhor encapsulante entre os três estudados. Foram obtidas microcápsulas com tamanhos entre 8,2 e 14 |im, superfície contínua sobre as paredes e ausência de poros. Verificou-se que a microencapsulação permitiu que os três encapsulantes protegessem o óleo e retivessem majoritariamente o seu perfil de ácidos graxos.
Palavras-Chave: Semente de amora, fluidos supercríticos, microencapsulação, microscopia eletrônica de varredura.
Introducción
En Colombia, la mora es una fruta muy apetecida para elaboración de productos como mermeladas, pulpas, conservas; entre otros (1). Se estima que en los últimos años la industria ha consumido aproximadamente 10000 toneladas por año. El procesamiento de mora estáligado a la generación de cantidades considerables de residuos que son dispuestos por las empresas como desechos y producen un impacto negativo al ambiente (2). Una forma de mitigar este impacto y dar valor agregado a estos desechos es generar subproductos que puedan ser usados en la industria cosmética y alimentaria, como por ejemplo el aceite obtenido de la semilla.
Los aceites pueden ser aislados mediante la tecnología de extracción con fluidos supercríticos (SFE) que tiene grandes ventajas: es selectiva, requiere menor tiempo, consume menos energía que otras y es limpia en términos ecológicos (3). Desafortunadamente, una vez extraídos, los aceites experimentan reacciones que conducen a la degradación oxidativa, por ello es necesario implementar técnicas que permitan conservar sus propiedades. La microencapsulación es una alternativa factible que permite la protección de compuestos bioactivos y su liberación controlada, aumentando la vida útil del producto (4).
El secado por aspersión es un método de microencapsulación ampliamente utilizado en la industria que consiste en la dispersión de la sustancia a encapsular en el agente encapsulante, seguido de una atomización de la muestra en una cámara a alta temperatura (5); el solvente se evapora instantáneamente y el material activo queda atrapado dentro de una película de material encapsulante (6).
En varios estudios (7-9) se ha concluido que el secado por atomización es adecuado para compuestos sensibles a altas temperaturas, proporciona buena estabilidad del producto final, requiere bajos costos de procesamiento y es fácil de implementar. Por ejemplo, en Rendón et al. (10), se estudió la estabilidad oxidativa de aceite de linaza microencapsulado y se comprobó que aplicando esta técnica existe una menor velocidad de degradación de los lípidos, concordando con los resultados obtenidos por Partanen et al. (11). De la misma forma, en Frascareli et al. (12) se microencapsuló aceite de café y se confirmó su eficacia en la protección contra la oxidación de lípidos, obteniendo resultados similares a Bae y Lee (13) con el aceite de aguacate.
Por otra parte, algunos autores (14, 15) se han interesado en microencapsular compuestos, pigmentos o extractos obtenidos a partir del fruto de la mora, obteniendo resultados favorables en cuanto a conservación y estabilidad. Sin embargo, dado que hasta el momento no se ha estudiado la microencapsulación de aceite de semillas de mora, el objetivo de esta investigación fue desarrollar un proceso de conservación de aceite de mora (Rubus glaucus) mediante microencapsulación por secado por aspersión y determinar la influencia de diferentes condiciones de operación en el rendimiento y la eficiencia del proceso, utilizando diferentes materiales encapsulantes: masterdry, goma arábiga y maltodextrina. Adicionalmente se evaluó el tamaño y morfología de las microcápsulas obtenidas.
Materiales y métodos
Materiales
Las semillas de mora (Rubus glaucus) fueron suministradas por la industria de procesos agroindustriales de Nariño (INPADENA). Inicialmente se realizó el acondicionamiento de las semillas retirando el exceso de pulpa. Seguidamente las semillas se secaron a 50 °C por 12 h en un secador de bandejas, se molieron y se empacaron al vacío. Como disolvente para la extracción con fluidos supercríticos se utilizó dióxido de carbono con una pureza del 99,8% v/v (Cryogas S.A., Colombia). Los materiales encapsulantes fueron goma arábiga master gum FT 1873-01 (Tecnas S.A.-Colombia), maltodextrina 18-22 (Tecnas S.A.-Colombia) y masterdry 13631-02 (mezcla de almidones modificados y goma arábiga prehidratada (Tecnas S.A.-Colombia)).
Los solventes utilizados para determinar la eficiencia del proceso de microencapsulación fueron: éter etílico (99,7% v/v, Panreac, España), Éter de Petróleo (40-60°C pure, Panreac, España), etanol (91% v/v, Fisher Scientific, USA), hexano (95% v/v, Panreac, España) y ácido clorhídríco (37% p/p, Panreac, España). Se empleó como emulgente Tween® 20 (Panreac, España).
Extracción con fluidos supercríticos
La extracción de aceite de semillas de mora se realizó en un equipo SFE 500 (Waters, USA). Para ello se colocaron 250 g de semillas molidas de mora en la celda de extracción, seguidamente se hizo pasar el CO2 empleando una bomba de desplazamiento positivo de alta presión, modelo P-50 (Thar, USA) hasta alcanzar 35 MPa. La temperatura dentro del recipiente se elevó y se mantuvo a 60 °C con una camisa de calefacción que envolvió el recipiente. Una vez alcanzadas las condiciones de operación (presión y temperatura) en la columna de extracción, se inició el proceso ajustando el flujo de CO2 a 30 g/min por un tiempo de 150 min. Finalmente, se despresurizó el equipo, el CO2 en estado gaseoso circuló hasta el escape y el aceite extraído se recogió en un vial ámbar.
Preparación de las emulsiones
Se prepararon emulsiones aceite en agua (O/W por sus siglas en inglés) con 30% p/p de sólidos de acuerdo al método descrito por Tuyen et al. (16), con algunas modificaciones. Para ello, se usaron masterdry, goma arábiga y maltodextrina como materiales encapsulantes. Se calentaron 35 g de agua destilada a 40 °C y como emulgente se adicionó 0,5 mL de Tween® 20. Lentamente se agregaron 12,5 g de goma arábiga o maltodextrina (en cada caso) y luego se incorporaron 2,5 g de aceite de mora; durante todo el procedimiento la mezcla se mantuvo en agitación magnética. Se homogenizó durante dos min a 30000 rpm, empleando un homogenizador home made tipo ultraturrax, fabricado con un motor de alta velocidad modelo 3000N/10 (Dremel, USA). Para realizar la emulsión con masterdry, se realizó el mismo procedimiento pero con agua a temperatura de 20 °C.
Microencapsulación de aceite de mora
La microencapsulación del aceite de mora se llevó a cabo empleando un secador spray BILON-6000Y (Shanghai, China), de acuerdo al método descrito por Tonon et al. (17). Inicialmente, se pre-calentó la cámara de secado para garantizar que la temperatura en toda la cámara fuera uniforme. Se variaron las condiciones de proceso para cada prueba como se indica en la Tabla 1. Se alimentaron las emulsiones al equipo por medio de una bomba peristáltica y el caudal de alimentación se controló por la velocidad de rotación de la bomba. Las microcápsulas obtenidas se almacenaron a 3 °C por tres meses en viales ámbar para su posterior análisis.
Diseño experimental y análisis estadístico
Para determinar las diferencias entre tratamientos se realizó el análisis de varianza (ANOVA) y la prueba de rangos múltiples de Tukey utilizando el software Statgraphics® Centurion XVI (StatPoint Technologies, Inc., Warrenton, VA, USA). Se utilizó un diseño experimental factorial 23 con cuatro puntos centrales, para un total de 12 experimentos por cada encapsulante (Tabla 1). Los ensayos se realizaron de manera aleatoria y con cuatro réplicas en el punto central.
Rendimiento de la microencapsulación (EY)
El rendimiento fue calculado como la relación entre el contenido de sólidos totales en el polvo resultante y el total de contenido de sólidos en la mezcla de alimentación expresado como porcentaje (16, 18), mediante la ecuación [1]:
Donde: EY = rendimiento de la microencapsulación en porcentaje de masa, Wm = peso total de microcápsulas obtenido (g) y W0 = sólidos totales de entrada en la emulsión (g)
Eficiencia de la microencapsulación (EE)
La eficiencia fue calculada con base en el aceite de mora retenido dentro de las microcápsulas mediante la ecuación [2]:
Donde: EE = eficiencia de la microencapsulación en porcentaje en masa, AT = aceite total presente en las microcápsulas (g) y AS = aceite superficial presente en las microcápsulas (g).
El contenido total de aceite se cuantificó utilizando como referencia el método AOAC 922.06 (19), con algunas modificaciones. El método consiste en hidrólisis ácida, extracción con disolvente, recuperación del aceite por rotavapor y análisis gravimétrico.
Para ello se transfirieron 2 g de microcápsulas a un tubo de 50 mL, se añadieron 2 mL de etanol y se mezcló para humedecer todas las partículas. Luego se añadieron 10 mL de una solución de HCl (25 mL de HCl al 37 % p/p y 11 mL de agua grado HPLC), se puso el tubo en un baño de agua a 75 °C y se agitó a intervalos frecuentes durante 40 min. Se añadieron 10 mL de etanol y se enfrió. Se transfirió la mezcla a un embudo de decantación, se añadieron 25 mL de éter etílico en tres porciones y se agitó vigorosamente durante 1 min. Seguidamente se agregaron 25 mL de éter de petróleo de forma continua y se agitó durante 1 min. La mezcla de éter-grasa fue separada y filtrada a través de una compresa de algodón. Se extrajo nuevamente la solución restante en el embudo dos veces, cada vez con 10 mL de cada éter; luego se secó la mezcla en rotavapor a 40 °C. Finalmente, el aceite se secó en horno a una temperatura de 100 °C hasta obtener peso constante y se dejó enfriar a temperatura ambiente.
El aceite superficial se determinó siguiendo el método empleado por Bae y Lee (15) con algunas modificaciones. Se pesaron 2 g de muestra en un tubo de vidrio con tapón de rosca y se añadieron 13 mL de hexano. El tubo se llevó a un agitador de vórtice durante 2 min para extraer el aceite libre, la mezcla se decantó y filtró usando papel filtro marca Munktell (grado 388, diámetro: 125 mm); el polvo se enjuagó tres veces con 20 mL de hexano. Por último, se recogió el polvo, se secó a temperatura ambiente para eliminar el solvente residual y se registró el peso final.
Estabilidad de los ácidos grasos de aceite de mora microencapsulado
Se determinó por cromatografía de gases con detector de ionización de llama (CG-FID), usando un sistema de la versión 3 Shimadzu GC-17A (Shimadzu, Kyoto, Japón), equipado con una columna DB-WAX (30 m x 0,25 mm I.D. y 0,25 μm df, J&W de Agilent Scientific, EE.UU.), un inyector split/splitless y un detector de ionización de llama (FID) (280 °C), siguiendo la metodología de Hurtado et al. (20).
Para este análisis se usó una muestra del aceite extraído con CO2 supercrítico y se comparó con el aceite obtenido de la determinación de aceite total presente en las microcápsulas resultantes de los ensayos en los cuales se obtuvo los mejores valores para rendimiento y eficiencia de la microencapsulación. Los ácidos grasos se derivatizaron para obtener sus respectivos ésteres metílicos.
La separación se realizó de acuerdo con la siguiente programación de temperatura del horno: temperatura inicial 40 °C, se mantuvo durante 5 min y después se elevó a 250 °C en 5 °C/ min. El volumen de inyección fue de 1,0 μl en modo split (relación 1:10), manteniendo la temperatura del inyector a 250 °C. Se empleó helio como gas portador con un caudal de 1 mL/min. Las velocidades de flujo de los gases de combustión (FID) fueron 300 mL/min y 30 mL/ min para el aire y el hidrógeno, respectivamente.
La recolección y manipulación de datos se llevó a cabo usando el software Shimadzu Clase VP 4.3. La identificación de ácidos grasos se realizó empleando estándares de ésteres metílicos de ácidos grasos FAME's (Restek, Bellafonte, EE.UU.). La cuantificación se llevó a cabo mediante el método de normalización relativa de área cromatográfica en términos porcentuales.
Morfología y el tamaño de las microcápsulas mediante Microscopia Electrónica de Barrido (SEM)
Se examinó la morfología y el tamaño de las microcápsulas con un microscopio electrónico de barrido VEGA3 SB (TESCAN, Republica Checa). Se realizó un proceso de suspensión de las microcápsulas empleando hexano como solvente; posteriormente, se realizó la fijación de cada muestra en un pin metálico. Las muestras fijadas fueron observadas usando SEM, funcionando a un voltaje de aceleración de 10, 7 y 5 kV Las micrografias correspondientes fueron capturadas El tamaño de partícula se determinó como el diámetro medio de Sauter (SMD = Sauter Mean Diameter = D[32]) utilizando la ecuación [3].
Donde Dpi es diámetro promedio de las partículas, tomado como la media aritmética de los diámetros mayor y menor y Ni es el número de partículas de diámetro Dpi.
Resultados y Discusión
Rendimiento de la microencapsulación
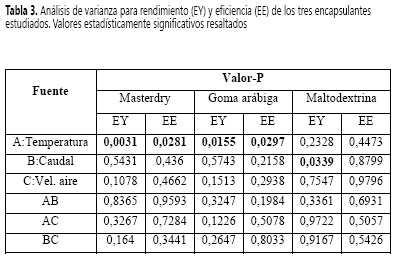
En la Tabla 2 se presentan los datos de rendimiento del proceso de microencapsulación. Se obtuvieron rendimientos en el rango de 87,5 a 91,8 ± 0,6% para masterdry, 84,2 a 89,9 ± 1,2% para goma arábiga y 86,4 a 90 ± 0,2% para maltodextrina. Los valores resaltados en negrilla corresponden a los resultados en los cuales se obtiene mayor rendimiento y eficiencia.
Mediante el análisis de varianza (p < 0,05) (Tabla 3), se encontró que, cuando se emplea masterdry y goma arábiga, la temperatura de entrada del aire tiene un efecto significativo y afecta de manera positiva el rendimiento, como se observa en la Figura 1.
Por tanto, con el incremento de la temperatura, aumenta el rendimiento del proceso. Esto ocurre cuando, en el secado por atomización, se utilizan altas temperaturas de entrada, pues se produce mayor eficiencia en los procesos de transferencia de calor y de masa (17, 18). Los resultados obtenidos son similares a los reportados por Cai et al. (21, 22), quienes trabajaron el secado por aspersión de betacianinas de Amaranthus y antocianinas de berenjena, respectivamente.
Para maltodextrina, el caudal de alimentación de la emulsión afecta el rendimiento de manera negativa, como se observa en la Figura 1. Esto se debe a que, con una mayor tasa de alimentación, la transferencia de calor y masa es más lenta (17). Además, cuando se empleó alta velocidad de alimentación, se observaron aglomeraciones de microcápsulas en algunos sectores del equipo que no pueden ser recuperados, disminuyendo el rendimiento del proceso. En Toneli et al. (23) se estudió el secado por atomización de la inulina y se encontró que, con la disminución de la velocidad de la bomba, aumenta el rendimiento.
Eficiencia de la microencapsulación
Los resultados de la eficiencia de la microencapsulación se muestran en la Tabla 2. Se obtuvieron eficiencias en el rango de 50,4 a 82,6 ± 0,5% para masterdry, 42,2 a 81,3 ± 0,6% para goma arábiga y 48,2 a 70 ± 1,3% para maltodextrina. A partir del análisis de varianza (ANOVA) que se muestra en la Tabla 3, se observó que sólo la temperatura tuvo efecto significativo sobre la eficiencia cuando se utilizaron masterdry y goma arábiga como encapsulantes. En el caso de la maltodextrina, ninguna variable fue estadísticamente significativa. Se encontró que la temperatura de entrada de aire influye de manera negativa en la eficiencia como se muestra en la Figura 2, es decir, a medida que se incrementa la temperatura, la eficiencia disminuye. Estos resultados son acordes con los obtenidos por Frascareli et al. (12), quienes estudiaron el efecto de las condiciones de proceso en la microencapsulación de aceite de café mediante secado por aspersión.
Esta tendencia se presenta también en otros estudios de microencapsulación mediante secado por atomización (24, 25) donde se ha demostrado que a temperaturas entre 150 °C y 175 °C, se obtienen altas eficiencias. Esto se relaciona, específicamente, con el hecho de que, a elevadas temperaturas, se afecta el balance entre la velocidad de evaporación de agua y la formación de la película del material de pared, lo que lleva a la ruptura de la membrana formada (26). Las altas temperaturas del aire de entrada generan encapsulados con una capa delgada de recubrimiento que favorece la liberación adelantada y degradación del compuesto encapsulado, lo que se traduce en la disminución de la eficiencia de la microencapsulación. Debido a que el rendimiento y la eficiencia de la microencapsulación se vieron directamente afectados por la temperatura de entrada del aire, se determinó la combinación de los factores experimentales que simultáneamente maximizan el rendimiento y eficiencia mediante el análisis estadístico de optimización de múltiples respuestas; los resultados para cada material encapsulante se muestran resaltados en negrilla en la Tabla 2.
Estudio del efecto de diferentes materiales en la microencapsulación de aceite de mora
Dado que es importante considerar el efecto de las dos variables en el producto final, la comparación de los diferentes materiales encapsulantes se realizó utilizando el criterio de rendimiento por eficiencia (EY x EE), evaluado en los cuatro puntos centrales establecidos en el diseño experimental.
Con este propósito, se utilizó la prueba de rangos múltiples HSD de Tukey, basada en las medias de los tratamientos para rendimiento y eficiencia. Los resultados muestran diferencias estadísticamente significativas con 95% de nivel de confianza. En la Figura 3 se observa que los mejores resultados se obtuvieron con goma arábiga. Dichos resultados son similares a los obtenidos en el estudio realizado por Krishnan et al. (8) para la encapsulación de oleorresina de cardamomo, donde la goma arábiga también exhibió mejor protección del material encapsulado que la maltodextrina y el almidón modificado HiCap100.
Los resultados obtenidos con la goma árabiga en este estudio se deben a su capacidad para formar emulsiones estables con la mayoría de los aceites en un amplio intervalo de pH y formar una película viscoelástica visible en la interfase de aceite/agua (25). A su vez, sus características estructurales le confieren un carácter anfifílico lo que le permite adsorber en superficies lipofílicas y actuar como un coloide protector y, consecuentemente, como un buen agente formador de cápsulas y películas.
Por otro lado, el masterdry resultó ser mejor encapsulante que la maltodextrina en cuanto a efectividad de encapsulación. Este producto es un buen encapsulante debido a que en su composición se incluye una mezcla de almidones modificados de maíz y goma arábiga. Por su parte, la maltodextrina exhibe una pobre capacidad emulsificante, baja estabilidad de la emulsión y baja retención de aceite (27), que da como resultado una baja eficiencia de encapsulación.
Análisis y comparación de la composición del aceite de mora antes y después del proceso de microencapsulación
El perfil de ácidos grasos del aceite de mora se reporta en la Tabla 4. Se identificaron cinco ácidos grasos principales a partir del análisis cromatográfico del aceite de mora antes de ser encapsulado, entre ellos tres ácidos insaturados (linoleico, linolénico y oleico) y dos ácidos grasos saturados (palmítico y esteárico), mencionados en orden de abundancia. Por otro lado, en todos los aceites encapsulados se observó una disminución en la cantidad de ácidos grasos insaturados y un aumento en los ácidos grasos saturados con respecto al aceite inicial sin encapsular, resultados acordes con los obtenidos en otras investigaciones (28-30).
En Calvo et al. (31) se afirma que el grado de insaturación de los ácidos grasos afecta de manera negativa la estabilidad de los aceites. Por lo anterior, se puede inferir que el aceite de mora tiende a degradarse con facilidad en condiciones ambientales, dado que en la muestra de aceite sin encapsular los ácidos grasos mayoritarios fueron los poliinsaturados (85,35%). Sin embargo, en los aceites obtenidos a partir de los encapsulados de masterdry, goma arábiga y maltodextrina, la degradación es mínima, considerando que las microcápsulas se almacenaron por tres meses; se puede afirmar entonces que el proceso de microencapsulación fue efectivo manteniendo el perfil de ácidos grasos.
Entre los aceites encapsulados, se encontró que el perfil de ácidos grasos de aceite de mora se conserva mejor cuando se emplea goma arábiga como material de pared, lo cual puede atribuirse a la naturaleza del encapsulante y la eficiencia de encapsulación obtenida, mencionada anteriormente.
Evaluación del tamaño y la morfología de las microcápsulas obtenidas
El tamaño de las microcápsulas obtenidas se reporta en la Tabla 5. En López et al. (30) se afirma que en equipos de secado por aspersión, a escala de laboratorio, el intervalo que se reporta para el diámetro medio de Sauter D[3,2] de las microcápsulas producidas es de 5 a 20 μm. Lo anterior es acorde a los resultados obtenidos en la presente investigación.
En cuanto a la morfología, se observa que las microcápsulas producidas con masterdry (Figura 4 (a)) presentan una forma esférica, sin porosidades y con pared continua. Sin embargo, se presentan abolladuras superficiales, producto de la contracción de las microcápsulas que ocurre por la elevada velocidad de evaporación, causada a su vez por la diferencia entre la temperatura de entrada y salida del spray durante el proceso de secado por atomización (32, 33). Los almidones modificados son susceptibles a la contracción durante el secado (34). Resultados similares obtuvo Loksuwan (34) con p-caroteno microencapsulado a través de secado por aspersión con almidones de tapioca.
Por otro lado, en las micrografias obtenidas para goma arábiga (Figura 4 (b)), se observan superficies externas redondeadas, arrugadas y cóncavas, sin fisuras evidentes y con pared continua. Esto se debe a la propiedad viscoelástica y de formación de la pared propia de la goma arábiga, lo que genera menor permeabilidad a los gases y es importante para la protección del aceite encapsulado (9, 25); la ausencia de poros indica una cobertura completa de la goma sobre el aceite (72). Morfología similar fue observada por Bertolini et al. (35) y Trinidade y Grosso (36), quienes microencapsularon con goma arábiga monoterpenos y ácido ascórbico, respectivamente. Finalmente en las microcápsulas obtenidas con maltodextrina (Figura 4 (c)) se observa una estructura esférica y redondeada, con una superficie lisa en su mayoría pero también algunas con pequeñas abolladuras. Esto concuerda con los resultados observados por Caparino et al. (37) y Ersus y Yurdagel (38) en sus estudios de microencapsulación por secado por atomización, empleando maltodextrina como encapsulante en extractos de mango y pigmentos de zanahoria negra (Daucus carota L) respectivamente. Así mismo, Olaya et al. (75) reportaron partículas que exhibían superficie lisa en la microencapsulación con maltodextrina de antocianinas de mora de castilla (Rubus glaucus) y lulo (Solanum betaceum).
Conclusiones
Con este estudio, se demuestra la posibilidad de obtener microcápsulas de aceite de mora utilizando como materiales encapsulantes masterdry, goma arábiga y maltodextrina mediante la técnica de secado por aspersión.
En el proceso de microencapsulación, la temperatura de entrada del aire fue la única variable estadísticamente significativa que afectó de manera positiva el rendimiento y de forma negativa la eficiencia, cuando se usaron como encapsulantes masterdry y goma arábiga. El caudal de alimentación de emulsión fue estadísticamente significativo e influenció negativamente el rendimiento del proceso únicamente cuando se usó maltodextrina como material encapsulante. La velocidad de entrada del aire no tuvo efecto significativo sobre el rendimiento y la eficiencia del proceso.
La goma arábiga resultó ser el mejor encapsulante debido a su conformación estructural que le confiere excelentes propiedades tanto emulsificantes como formadoras de película. En cuanto al tamaño de partícula, se obtuvieron microcápsulas con tamaños de 8,2; 11,8 y 14 μm, para masterdry, goma arábiga y maltodextrina, respectivamente. Esto concuerda con lo reportado en la literatura, donde el intervalo de tamaños para microcápsulas obtenidas en equipos de secado por aspersión varia de 5 a 20 μm. Respecto a la morfología, en todos los encapsulados se observó una superficie continua en las paredes con ausencia de poros o grietas, lo que estárelacionado con las altas eficiencias de microencapsulación. Finalmente, el proceso de microencapsulación con los tres encapsulantes estudiados permitió proteger el aceite de mora y conservar su perfil de ácidos grasos, en su mayoría, durante tres meses.
Referencias
1. Grijalba Rativa, M.; Calderón Medellín, A.; Pérez Trujillo, M. Rendimiento y calidad de la fruta en mora de castilla (Rubus glaucus) con y sin espinas, cultivada en el campo abierto en Cajicá(Cundinamarca, Colombia). Revista Facultad de Ciencias Básicas 2010, 6 (1), 24-41.
2. Cardona, J. 2500 toneladas diarias de basura buscan acomodarse. Rev. Amb. El Reto. 2002, 42, 20-27.
3. Hurtado Benavides, A.; Martín Álvarez, P. J.; Vázquez, L.; Reglero, G.; Señoráns, F. J.; Ibanez, E. Optimization of countercurrent supercritical fluid extraction of minor components from olive oil. Curr. Anal. Chem. 2014, 10, 78-85. DOI: https://doi.org/10.2174/1573411011410010007.
4. Martins, M.; Barreiro, M. R; Coelho, M.; Rodrigues, A. Microencapsulation of essential oils with biodegradable polymeric carriers for cosmetic applications. Chem. Eng. J. 2014, 245, 191- 200. DOI: https://doi.org/10.1016/j.cej.2014.02.024.
5. Dziezak ZD. Microencapsulation and encapsulation ingredients. J. FoodTechnol. 1998, 42, 136-151.
6. López, O. Microencapsulación de sustancias oleosas mediante secado por aspersión. Revista Cubana de Farmacia 2010, 33 (3), 381-389.
7. Favaro, C.; Santana, A.; Monterrey, E.; Trinidade, M.; Netto, F. The use of spray drying technology to reduce bitter taste of casein hydrolysate Food Hydrocolloids 2010, 24 (4), 336-340 DOI: https://doi.org/10.1016/j.foodhyd.2009.10.012.
8. Krishnan, S.; Kshirsagar, A. C, Singhal, R. S. The use of gum arabic and modified starch in the microencapsulation of a food flavoring agent. Carbohydr Polym. 2005, 62, 309-315. DOI: https://doi.org/10.1016/jxarbpol.2005.03.020.
9. Jimenez, M.; García, H. S.; Beristain, C. I. Spray-drying microencapsulation and oxidative stability of conjugated linoleic acid. Eur. Food Res. Technol. 2004, 219, 588-592. DOI: https://doi.org/10.1007/s00217-004-0992-4.
10. Rendón Galindo, G. M.; Báez González, J. G.; Alanis Guzmán, M. G.; Regalado Méndeza, A.; Vernon Carter, E. J. Estabilidad oxidativa de aceite de linaza microencapsulado con multicapas de biopolimeros. AMIDIQ. 2010, 2207-2212.
11. Partanen, R.; Raula, J.; Seppanen, J.; Buchert, J.; Kauppinen, E.; Forssell, P. Effect of relative humidity on oxidation of flaxseed oil in spray dried whey protein emulsions. J. Agric Food Chem 2008, 56 (14), 5717-5722. DOI: https://doi.org/10.1021/jf8005849.
12. Frascareli, E. C.; Silvaa, V. M.; Tonon, R. V.; Hubinger, M. D. Effect of process conditions on the microencapsulation of coffee oil by spray drying. Food Bioprod. Process. 2012, 90, 413-424. DOI: https://doi.org/10.1016/j.fbp.2011.12.002.
13. Bae, E. K.; Lee, S. J. Microencapsulation of avocado oil by spray drying using whey protein and maltodextrin. J. Microencapsul 2008, 25 (8), 549-560. DOI: https://doi.org/10.1080/02652040802075682.
14. Villacrez, J. L.; Carriazo, J. G.; Osorio, C. Microencapsulation of Andes Berry (Rubus glaucus Benth.) aqueous extract by spray drying. Food Bioprocess Technol. 2014, 7 (5), 1445-1456. DOI: https://doi.org/10.1007/s11947-013-1172-y.
15.Olaya, C.; Castaño, M.; Garzón, G. Efecto de la temperatura, almacenamiento y la actividad de agua sobre la estabilidad de antocianinas de Rubus glaucus y Solanum betaceum Cav.dark-red strain. Acta biol. Colomb. 2009, 14 (3), 141-156.
16. Kha, T. C.; Nguyen, M. H.; Roach, P. D.; Stathopoulos, C. E. Microencapsulation of Gac oil: Optimisation of spray drying conditions using response surface methodology. Powder Technol. 2014, 264, 298-309. DOI: https://doi.org/10.1016/j.powtec.2014.05.053.
17. Tonon, R V.; Brabet, C.; Hubinger, M D. Influence of process conditions on thephysicochemical properties of açai (Euterpe oleraceae Mart ) powder produced by spray drying J Food Eng 2008, 88, 411-418. DOI:https://doi.org/10.1016/j.jfoodeng.2008.02.029.
18. Tee, L. H.; Chuah, L. A.; Pin, K. Y.; Rashih, A. A.; Yusof, Y. A. A. Optimization of spray drying process parameters of Piper betle L. (sirih) leaves extract coated with maltode trin J. Chem Pharm Res. 2012, 4 (3), 1833-1841.
19. AOAC Official Method 922 06 Fat in Flour Acid Hydrolysis Method: Association of Official Analytical Chemists; 2005.
20. Hurtado-Benavides, A.; Dorado, D A., Sánchez-Camargo, A P Study of the fatty acid profile and the aroma composition of oil obtained from roasted Colombian coffee beans by supercritical fluid extraction. J. Supercrit. Fluids 2016, 113, 44-52. DOI: https://doi.org/10.1016/j.supflu.2016.03.008.
21. Cai, Y. Z.; Corke, H. Production and Properties of Spray-dried Amaranthus Betacyanin Pigments. J. Food Sci 2000, 65 (16), 1248-1252. DOI: https://doi.org/10.1111/j.1365-2621.2000.tb10273.x.
22. Arrazola, G.; Herazo, I.; Alvis, A. Microencapsulación de Antocianinas de Berenjena (Solanum melongena L.) mediante Secado por Aspersión y Evaluaciónde la Estabilidad de su Color y Capacidad Antioxidante. Inf. Tecnol. 2014, 25 (3), 31-42. DOI: https://doi.org/10.4067/S0718-07642014000300006.
23. Toneli, J.; Park, K. J.; Murr, F.; Negreiros, A. Spray drying optimization to obtain inulin powder. Proceedings of the 15th International Drying Symposium. 2006.
24. Bringas-Lantigua, M.; Expósito-Molina, I, Reineccius, G. A.; López-Hernández, O.; Pino, J. A. Influence of spray-dryer air temperatures on encapsulated mandarin oil. Drying Technol 2011, 29, 1511-1517. DOI: https://doi.org/10.1080/07373937.2010.513780.
25. Gharsallaoui, A.; Roudaut, G.; Chambin, O.; Voilley, A.; Saurel, R. Applications of spray-drying in microencapsulation of food ingredients: An overview. Food Res. Int. 2007, 40, 1107-1121. DOI: https://doi.org/10.1016/j.foodres.2007.07.004.
26. Gómez-Cruz, N. I.; Jiménez-Munguia, M. T. Metodos de secado de emulsiones alimentarias. TSIA. 2014, 8 (2), 23-33.
27. Kenyon, M. Modified starch, maltodextrin, and corn syrup solids as wall materials for food encapsulation. ACS symposium series. ACS Symp. Ser. 1995, 590, 42-50. DOI: https://doi.org/10.1021/bk-1995-0590.ch004.
28. Czerniak, A.; Kubiak, P.; Bialas, W.; Jankowski, T. Improvement of o idative stability of menhaden fish oil by microencapsulation within biocapsules formed of yeast cells J. Food Eng 2015, 167, 2-11. DOI: https://doi.org/10.1016/jjfoodeng.2015.0L002.
29. Calvo, P.; Hernández, T.; Lozano, M.; González-Gómez, D Microencapsulation of extra-virgin olive oil by spray-drying: Influence of wall material and olive quality. Eur. J. Lipid Sci. Technol. 2010, 112, 852-858. DOI: https://doi.org/10.1002/ejlt.201000059.
30. López, O.; Márquez, T.; Mayo, O.; Toledo, C.; Pérez, E. Características del aceite de semillas de Cucurbita pepo L. microencapsulado mediante secado por aspersión con maltodextrina y goma arábiga. Lat. Am. Journal of Pharmacy 2009, 28 (4), 628-632.
31. Calvo, P.; Castaño, Á.; Lozano, M.; González-Gómez, D. Influence of the microencapsulation on the quality parameters and shelf-life of extra-virgin olive oil encapsulated in the presence of BHT and different capsule wall components Food Res Int 2012, 45, 256-261. DOI: https://doi.org/10.1016/j.foodres.2011.10.036.
32. Rosenberg, M.; Kopelman, I. J.; Talmon, Y. A scanning electron microscopy study of microencapsulation. J. Food Sci 1985, 50, 139-144. DOI: https://doi.org/10.1111/j.1365-2621.1985.tb13295.x.
33. Rosenberg, M.; Kopelman, I. J.; Talmon, Y Factors affecting retention in spray-drying microencapsulation of volatile materials. J. Agric. and Food Chem. 1990, 50, 139-144. DOI: https://doi.org/10.1021/jf00095a030.
34. Loksuwan, J. Characteristics of microencapsulated b-carotene formed by spray drying with modified tapioca starch, native tapioca starch and maltodextrin. Food Hydrocolloids 2007, 21, 928-935. DOI: https://doi.org/10.1016/j.foodhyd.2006.10.011.
35. Bertolini, A. C.; Siani, A. C.; Grosso, C. R. Stability of monoterpenes encapsulated in gum arabic by spray-drying. J. Agric. Food Chem. 2001, 49, 780-785. DOI: https://doi.org/10.1021/jf000436y.
36. Trindade, M. A.; Grosso, C. R. The stability of ascorbic acid microencapsulated in granules of rice starch and in gum Arabic. J. Microencapsul. 2000, 17, 169-176. DOI: https://doi.org/10.1080/026520400288409.
37. Caparino, O.; Tang, J.; Nindo, C.; Sablani, S. Powers, J.; Fellman, J. Effect of drying methods on the physical properties and microstructures of mango (Philippine 'Carabao' var.) powder. J. Food Eng. 2012, 111, 135-148. DOI: https://doi.org/10.1016/j.jfoodeng.2012.01.010.
38. Ersus, S.; Yurdagel, U. Microencapsulation of anthocyanin pigments of blackcarrot (Daucuscarota L.) by spray dryer. J. Food Eng. 2007, 80 (3), 805-812. DOI: https://doi.org/10.1016/j.jfoodeng.2006.07.009.
Referencias
Grijalba Rativa, M.; Calderón Medellín, A.; Pérez Trujillo, M. Rendimiento y calidad de la fruta en mora de castilla (Rubus glaucus) con y sin espinas, cultivada en el campo abierto en Cajicá (Cundinamarca, Colombia). Revista Facultad de Ciencias Básicas. 2010; 6(1): p. 24-41.
Cardona, J. 2500 toneladas diarias de basura buscan acomodarse. Rev. Amb. El Reto. 2002; 42: p. 20-27.
Hurtado Benavides, A.; Martín Álvarez, P. J.; Vázquez, L.; Reglero, G.; Señoráns, F. J.; Ibanez, E. Optimization of countercurrent supercritical fluid extraction of minor components from olive oil. Current Analytical Chemistry. 2014; 10: p. 78-85. DOI: http://dx.doi.org/10.2174/1573411011410010007.
Martins, M.; Barreiro, M. F.; Coelho, M.; Rodrigues, A. Microencapsulation of essential oils with biodegradable polymeric carriers for cosmetic applications. Chem. Eng. J. 2014; 245: p. 191–200. DOI: http://dx.doi.org/10.1016/j.cej.2014.02.024.
Dziezak JD. Microencapsulation and encapsulation ingredients. J. Food Technol. 1998; 42: p. 136‐151.
López, O. Microencapsulación de sustancias oleosas mediante secado por aspersión. Revista Cubana de Farmacia. 2010; 33(3): p. 381-389.
Favaro, C.; Santana, A.; Monterrey, E.; Trinidade, M.; Netto, F. The use of spray drying technology to reduce bitter taste of casein hydrolysate. Food Hydrocolloids. 2010; 24(4): p. 336-340. DOI: http://dx.doi.org/10.1016/j.foodhyd.2009.10.012.
Krishnan, S.; Kshirsagar, A. C, Singhal, R. S. The use of gum arabic and modified starch in the microencapsulation of a food flavoring agent. Carbohydr Polym. 2005; 62: p. 309–315. DOI: http://dx.doi.org/10.1016/j.carbpol.2005.03.020.
Jimenez, M.; García, H. S.; Beristain, C. I. Spray-drying microencapsulation and oxidative stability of conjugated linoleic acid. Eur. Food Res. Technol. 2004; 219: p. 588–592. DOI: http://dx.doi.org/10.1007/s00217-004-0992-4.
Rendón Galindo, G. M.; Báez González, J. G.; Alanís Guzmán, M. G.; Regalado Méndeza, A.; Vernon Carter, E. J. Estabilidad oxidativa de aceite de linaza microencapsulado con multicapas de biopolimeros. AMIDIQ. 2010. p. 2207-2212.
Partanen, R.; Raula, J.; Seppänen, J.; Buchert, J.; Kauppinen, E.; Forssell, P. Effect of relative humidity on oxidation of flaxseed oil in spray dried whey protein emulsions. J. Agric. Food Chem. 2008; 56(14): p. 5717−5722. DOI: http://dx.doi.org/10.1021/jf8005849.
Frascareli, E. C.; Silvaa, V. M.; Tonon, R. V.; Hubinger, M. D. Effect of process conditions on the microencapsulation of coffee oil by spray drying. Food Bioprod. Process. 2012; 90: p. 413–424. DOI: http://dx.doi.org/10.1016/j.fbp.2011.12.002.
Bae, E. K.; Lee, S. J. Microencapsulation of avocado oil by spray drying using whey protein and maltodextrin. J. Microencapsul. 2008; 25(8): p. 549−560. DOI: http://dx.doi.org/10.1080/02652040802075682.
Villacrez, J. L.; Carriazo, J. G.; Osorio, C. Microencapsulation of Andes Berry (Rubus glaucus Benth.) aqueous extract by spray drying. Food Bioprocess Technol. 2014; 7(5): p. 1445-1456. DOI: http://dx.doi.org/10.1007/s11947-013-1172-y.
Olaya, C.; Castaño, M.; Garzón, G. Efecto de la temperatura, almacenamiento y la actividad de agua sobre la estabilidad de antocianinas de Rubus glaucus y Solanum betaceum Cav.dark-red strain. Acta biol. Colomb. 2009; 14(3): p. 141-156.
Kha, T. C.; Nguyen, M. H.; Roach, P. D.; Stathopoulos, C. E. Microencapsulation of Gac oil: Optimisation of spray drying conditions using response surface methodology. Powder Technol. 2014; 264: p. 298–309. DOI: http://dx.doi.org/10.1016/j.powtec.2014.05.053.
Tonon, R. V.; Brabet, C.; Hubinger, M. D. Influence of process conditions on the physicochemical properties of açai (Euterpe oleraceae Mart.) powder produced by spray drying. J. Food Eng. 2008; 88: p. 411–418. DOI: http://dx.doi.org/10.1016/j.jfoodeng.2008.02.029.
Tee, L. H.; Luqman Chuah. A.; Pin, K. Y.;, Abdull Rashih, A.; Yusof, Y.A. Optimization of spray drying process parameters of Piper betle L. J. Chem. Pharm. Res. 2012; 4(3): p. 1833-1841.
AOAC. Official Method 922.06. Fat in Flour Acid Hydrolysis Method: Association of Official Analytical Chemists; 2005.
Hurtado-Benavides, A.; Dorado, D. A., Sánchez-Camargo, A. P. Study of the fatty acid profile and the aroma composition of oil obtained from roasted Colombian coffee beans by supercritical fluid extraction. J. Supercrit. Fluids 2016; 113: p. 44–52. DOI: http://dx.doi.org/10.1016/j.supflu.2016.03.008.
Cai, Y. Z.; Corke, H. Production and Properties of Spray-dried Amaranthus Betacyanin Pigments. J. Food Sci. 2000; 65(16): p. 1248-1252. DOI: http://dx.doi.org/10.1111/j.1365-2621.2000.tb10273.x.
Arrazola , G.; Herazo, I.; Alvis, A. Microencapsulación de Antocianinas de Berenjena (Solanum melongena L.) mediante Secado por Aspersión y Evaluaciónde la Estabilidad de su Color y Capacidad Antioxidante. Inf. Tecnol. 2014; 25(3): p. 31-42. DOI: http://dx.doi.org/10.4067/S0718-07642014000300006.
Toneli, J.; Park, K. J.; Murr, F.; Negreiros, A. Spray drying optimization to obtain inulin powder. Proceedings of the 15th International Drying Symposium. 2006.
Bringas-Lantigua, M.; Expósito-Molina, I, Reineccius, G. A.; López-Hernández, O.; Pino, J. A. Influence of spray-dryer air temperatures on encapsulated mandarin oil. Drying Technol. 2011; 29: p. 1511-1517. DOI: http://dx.doi.org/10.1080/07373937.2010.513780.
Gharsallaoui, A.; Roudaut, G.; Chambin, O.; Voilley, A.; Saurel, R. Applications of spray-drying in microencapsulation of food ingredients: An overview. Food Res. Int. 2007; 40: p. 1107–1121. DOI: http://dx.doi.org/10.1016/j.foodres.2007.07.004.
Gómez-Cruz, N. I.; Jiménez-Munguia, M. T. Metodos de secado de emulsiones alimentarias. TSIA. 2014; 8(2): p. 23-33.
Kenyon, M. Modified starch, maltodextrin, and corn syrup solids as wall materials for food encapsulation. ACS symposium series. ACS Symp. Ser. 1995, 590, 42–50. DOI: http://dx.doi.org/10.1021/bk-1995-0590.ch004
Czerniak, A.; Kubiak, P.; Białas, W.; Jankowski, T. Improvement of oxidative stability of menhaden fish oil by microencapsulation within biocapsules formed of yeast cells. J. Food Eng. 2015, 167, 2–11. DOI: http://dx.doi.org/10.1016/j.jfoodeng.2015.01.002
Calvo, P.; Hernández, T.; Lozano, M.; González-Gómez, D. Microencapsulation of extra-virgin olive oil by spray-drying: Influence of wall material and olive quality. Eur. J. Lipid Sci. Technol. 2010, 112, 852–858. DOI: http://dx.doi.org/10.1002/ejlt.201000059
López, O.; Márquez, T.; Mayo, O.; Toledo, C.; Pérez, E. Características del aceite de semillas de Cucurbita pepo L. microencapsulado mediante secado por aspersión con maltodextrina y goma arábiga. Lat. Am. Journal of Pharmacy. 2009, 28(4), 628-632.
Calvo, P.; Castaño, Á.; Lozano, M.; González-Gómez, D. Influence of the microencapsulation on the quality parameters and shelf-life of extra-virgin olive oil encapsulated in the presence of BHT and different capsule wall components. Food Res. Int. 2012, 45, 256–261. DOI: http://dx.doi.org/10.1016/j.foodres.2011.10.036
Rosenberg, M.; Kopelman, I. J.; Talmon, Y. A scanning electron microscopy study of microencapsulation. J. Food Sci. 1985, 50, 139–144. DOI: http://dx.doi.org/10.1111/j.1365-2621.1985.tb13295.x
Rosenberg, M.; Kopelman, I. J.; Talmon, Y. Factors affecting retention in spray-drying microencapsulation of volatile materials. J. Agric. and Food Chem. 1990, 50, 139–144. DOI: http://dx.doi.org/10.1021/jf00095a030
Loksuwan, J. Characteristics of microencapsulated b-carotene formed by spray drying with modified tapioca starch, native tapioca starch and maltodextrin. Food Hydrocolloids. 2007, 21, 928–935. DOI: http://dx.doi.org/10.1016/j.foodhyd.2006.10.011
Bertolini, A. C.; Siani, A. C.; Grosso, C. R. Stability of monoterpenes encapsulated in gum arabic by spray-drying. J. Agric. Food Chem. 2001, 49, 780–785. DOI: http://dx.doi.org/10.1021/jf000436y
Trindade, M. A.; Grosso, C. R. The stability of ascorbic acid microencapsulated in granules of rice starch and in gum Arabic. J. Microencapsul. 2000, 17,169–176. DOI: http://dx.doi.org/10.1080/026520400288409
Caparino, O.; Tang, J.; Nindo, C.; Sablani, S. Powers, J.; Fellman, J. Effect of drying methods on the physical properties and microstructures of mango (Philippine ‘Carabao’ var.) powder. J. Food Eng. 2012, 111, 135–148. DOI: http://dx.doi.org/10.1016/j.jfoodeng.2012.01.010
Ersus, S.; Yurdagel, U. Microencapsulation of anthocyanin pigments of blackcarrot (Daucuscarota L.) by spray dryer. J. Food Eng. 2007, 80 (3), 805–812. DOI: http://dx.doi.org/10.1016/j.jfoodeng.2006.07.009
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. David Arturo-Perdomo, Juan Pablo Jiménez Mora, Elena Ibáñez, Alejandro Cifuentes, Andrés Hurtado-Benavides, Lidia Montero. (2021). Extraction and Characterization of the Polar Lipid Fraction of Blackberry and Passion Fruit Seeds Oils Using Supercritical Fluid Extraction. Food Analytical Methods, 14(10), p.2026. https://doi.org/10.1007/s12161-021-02020-5.
2. Sara Rios-Aguirre, Maritza Andrea Gil-Garzón. (2021). Microencapsulación por secado por aspersión de compuestos bioactivos en diversas matrices: una revisión. TecnoLógicas, 24(51), p.e1836. https://doi.org/10.22430/22565337.1836.
3. Valentina Vargas, Sebastian Saldarriaga, Francis S. Sánchez, Liceth N. Cuellar, Gloria M. Paladines. (2024). Effects of the spray-drying process using maltodextrin on bioactive compounds and antioxidant activity of the pulp of the tropical fruit açai (Euterpe oleracea Mart.). Heliyon, 10(13), p.e33544. https://doi.org/10.1016/j.heliyon.2024.e33544.
4. Sarahi Rubio-Tinajero, Eduardo Osorio-Hernández, Benigno Estrada-Drouaillet, José Hugo Tomás Silva-Espinosa, Rafael Delgado-Martínez, César Alejandro Espinoza-Ahumada, Claudio Ríos-Velasco, Jorge Ariel Torres-Castillo. (2022). In vitro biocontrol of Fusarium oxysporum with antagonistic microorganisms and In vivo effect on Solanum lycopersicum L.. Journal of Environmental Science and Health, Part B, 57(8), p.625. https://doi.org/10.1080/03601234.2022.2093590.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).