Estudio de la adsorción de 4-nitrofenol desde solución acuosa sobre un carbón activado con heteroátomos nitrogenados en la superficie. Aplicación del modelo de Sips
Adsorption study of 4-nitrophenol from aqueous solution on activated carbon with nitrogen heteroatoms on its surface: application of the sips model
Estudo da adsorção de 4-nitrofenol a partir de solução aquosa de carvão ativado com heteroátomos azotados na superfície: aplicação do modelo de sips
DOI:
https://doi.org/10.15446/rev.colomb.quim.v47n1.64561Palabras clave:
Modelo de Sips, Modelo de Langmuir, Modelo de Freundlich, carbón activado, adsorción, 4-nitrofenol, SigmaPlot (es)Sips, Langmuir, Adsorption, Activated carbon, 4-nitrophenol, SigmaPlot (en)
Sips, Langmuir, carvão ativado, adsorção, 4-nitrofenol, programa SigmaPlot (pt)

Red de Revistas Científicas de América Latina y el Caribe, España y Portugal
Aplicada y Analítica
Estudio de la adsorción de 4-nitrofenol desde solución acuosa sobre un carbón activado con heteroátomos nitrogenados en la superficie. Aplicación del modelo de Sips
Adsorption study of 4-nitrophenol from aqueous solution on activated carbon with nitrogen heteroatoms on its surface: application of the sips model
Estudo da adsorção de 4-nitrofenol a partir de solução aquosa de carvão ativado com heteroátomos azotados na superfície: aplicação do modelo de sips
Estudio de la adsorción de 4-nitrofenol desde solución acuosa sobre un carbón activado con heteroátomos nitrogenados en la superficie. Aplicación del modelo de Sips
Revista Colombiana de Química, vol. 47, núm. 1, 2018
Universidad Nacional de Colombia
Recepción: 19 Abril 2017
Aprobación: 27 Junio 2017
Resumen: Se evaluó la aminación de un carbón activado preoxidado con ácido nítrico en la adsorción de 4-nitrofenol. Se aplicó el modelo de Sips a la adsorción desde solución acuosa, utilizando Sigmoidal Logistic 3 Parameter del programa SigmaPlot 12. Los parámetros obtenidos se compararon con los calculados con el programa Statistica 7 para los modelos de Sips y Langmuir. Se encontró que la modificación realizada sobre el carbón activado incrementó la adsorción de 4-nitrofenol de 2,16 a 2,19 mmol·g-1, aumentando, a su vez, la afinidad adsorbente-adsorbato. El parámetro para la energía característica del sistema determinado con el modelo de Langmuir toma un valor de 377,47 L·mmol-1 al no considerar la heterogeneidad energética, mientras que a partir del modelo de Sips se presenta un valor de 8,32 (L·mmol-1)1/n. Adicionalmente, se encontró que en la ecuación matemática Sigmoidal Logistic 3 Parameter del programa SigmaPlot el valor de 1/x0 corresponde a la constante KLF del modelo Langmuir-Freundlich, mientras que el valor del parámetro KS del modelo de Sips es igual a (1/x0)-b. Se concluye que la adsorción de 4-nitrofenol sobre el carbón activado se favorece por el incremento de grupos nitrogenados sobre su superficie.
Palabras clave: Sips, Langmuir, carbón activado, adsorción, 4-nitrofenol, SigmaPlot.
Abstract: The amination of a nitric acid pre oxidized activated carbon in the adsorption of 4-nitrophenol was evaluated. The Sips model application to the aqueous solution adsorption data, using Sigmoidal Logistic 3 Parameter formula, in the SigmaPlot 12 program was applied. The obtained parameters were compared with those calculated with Statistica 7 program for Sips and Langmuir models. It was found that the activated carbon increases the adsorption from 2.16 to 2.19 mmol·g-1, showing good adsorbent-adsorbate affinity. The system´s characteristic energy parameter calculated with the Langmuir model was 377.47 L·mmol-1, when not considering energy heterogeneity, while from the Sips model was 8.32 (L.mmol-1)1/n. Additionally, it was found that in the mathematical equation Sigmoidal Logistic 3 Parameter of the SigmaPlot program, the 1/x0 value corresponds to the Langmuir-Freundlich model constant KLF, while the parameter value KS in the Sips model is equal to (1/x0)-b in this program. It was concluded that the 4-nitrophenol adsorption on activated carbon is favored by the presence of nitrogen groups on their activated carbon surface.
Keywords: Sips, Langmuir, Adsorption, Activated carbon, 4-nitrophenol, SigmaPlot.
Resumo: Foi avaliada a aminação de um carvão ativado preoxidado com ácido nítrico na adsorção do 4-nitrofenol. Foi aplicado o modelo de Sips à adsorção desde solução aquosa usando Logística Sigmoidal 3 do programa Sigmaplot 12. Os parâmetros obtidos foram comparados com os calculados com o programa Statistica 7, para os modelos de Sips e Langmuir. Foi encontrado que a modificação do carvão ativado incrementou a adsorção de 4-nitrofenol de 2,16 até 2,19 mmol·g-1, acrescentando a afinidade adsorvente-adsorvato. O parâmetro para a energia característica do sistema calculado com o modelo Langmuir teve um valor de 377,47 L·mmol-1 porque não considerou a heterogeneidade energética, enquanto que no modelo de Sips este parâmetro teve um valor de 8,32 (L·mmol-1)1/n. Além disso, foi encontrado que na equação matemática Sigmoidal Logistic 3 Parameter do programa Sigmaplot 3 o valor de 1/x0 corresponde à constante KLF do modelo Langmuir-Freundlich, enquanto o valor do parâmetro KS do modelo de Sips é igual a (1/x0)-b. Conclui-se que a adsorção do 4-nitrofenol sobre carvão ativado é favorecida pela presença de grupos nitrogenado na superfície destes.
Palavras-chave: Sips, Langmuir, carvão ativado, adsorção, 4-nitrofenol, programa SigmaPlot.
Introducción
El carbón activado es uno de los sólidos adsorbentes más complejos y, al mismo tiempo, más versátil dentro de la industria. Proviene de materiales no grafitizables y, aunque no posee una estructura amorfa, exhibe un desorden estructural considerable que le proporciona porosidad y química superficial, lo cual lo convierte en un excelente material en los procesos de adsorción (1, 2). Por tanto, se ha utilizado en la remoción de contaminantes mediante el proceso de adsorción desde fase acuosa, los cuales son difíciles y costosos de remover como el 4-nitrofenol, catalogado por la US Enviromental Protection Agency (EPA) como tóxico, no degradable y bioacumulativo (3); este no se permite en concentraciones mayores a 0,02 mg·kg-1 en aguas para vertimiento al alcantarillado (4, 5).
El 4-nitrofenol es un contaminante producido en procesos químicos como el fraccionamiento del petróleo, producción de caucho, tratamiento de madera, tratamiento de pulpa de papel, producción de pinturas y plásticos, entre otros (6). Muchos de estos productos una vez utilizados, son liberados a las fuentes de agua y pueden permanecer allí después del tratamiento primario (7, 8), por tanto, se recurre a la adsorción sobre carbón activado para retirarlo (3).
La isoterma de adsorción permite determinar tanto la capacidad de adsorción del carbón activado como las interacciones energéticas que se presentan en el sistema y que dependen de las características tanto químicas como geométricas del adsorbente así como de la afinidad entre este y el adsorbato o el agua (9).
El estudio del proceso de adsorción desde solución se realiza mediante la aplicación de distintos modelos a las isotermas de adsorción, los cuales permiten describir los datos experimentales. Uno de estos modelos fue desarrollado por Sips en 1948 (10), este es un modelo empírico igual que el de Freundlich, y en su forma matemática es similar al modelo de Langmuir, no obstante, el de Sips presenta un límite finito cuando la concentración del soluto en la fase acuosa es suficientemente alta (11). El modelo de Sips también es conocido como el modelo Langmuir-Freundlich (13), no obstante, este último presenta una modificación respecto al modelo de Sips.
Para realizar el ajuste de los datos experimentales de adsorción a un modelo, se utilizan habitualmente programas de optimización no lineal dentro de los cuales se ha reportado el uso de MatLab, Statistica y SigmaPlot entre otros (11, 12).
Las ecuaciones de Langmuir y Freundlich pueden ajustarse fácilmente a una recta porque son modelos muy utilizados para describir los datos de adsorción. No obstante, no ofrecen una imagen general del proceso de adsorción. En la actualidad el uso de cálculos computacionales y estadísticos permite el ajuste de los datos de adsorción a modelos de más de dos parámetros como es el caso del modelo de Sips que, de acuerdo con otros estudios reportados (13, 14), describe mejor los datos de adsorción en un amplio rango de concentraciones.
El programa comercial SigmaPlot 12 contiene las ecuaciones correspondientes al modelo no lineal de Sips. Este programa proporciona los parámetros de ajuste a la isoterma y, además, los errores estadísticos del ajuste de los datos experimentales al modelo incluyendo los coeficientes de correlación R y R2, el error estándar SE, F-test y los valores de P, que permiten evaluar el grado de ajuste de los datos al modelo teórico (12).
El objetivo de este estudio fue evaluar el efecto de la modificación de un carbón activado mediante la introducción de grupos nitrogenados a un carbón activado preoxidado, en la adsorción de 4-nitrofenol desde solución acuosa. Adicionalmente, tomando como base la descripción que realizan Wu et al (12) sobre el uso del programa SigmaPlot en la categoría Sigmoidal, Logistic, 3 Parameter para el ajuste de los datos de adsorción de 4-clorofenol y colorantes desde solución acuosa al modelo de Sips, se analizó la descripción matemática de este programa, con el fin de aportar al ajuste de los datos de adsorción obtenidos en este estudio mediante el modelo de Sips.
Materiales y métodos
Preparación del carbón activado
Como material de partida se utilizó el carbón activado granular comercial, Carbochem 850 (Pensilvania, US), producido a partir de cáscara de coco (muestra G). Se modificó por impregnación con una solución de ácido nítrico al 60% p/p (preparado a partir de ácido nítrico Reactivo Merck 65% p.a., Colombia) en una relación de carbón activado a agente impregnante de 1:3 p/p (muestra GN). La impregnación se hizo a temperatura de 291 K, la muestra se mantuvo a esta temperatura durante 72 h; después se lavó con agua desionizada hasta pH constante. Posteriormente, la muestra se colocó en reflujo en solución al 25% p/p de hidróxido de amonio (Reactivo Merck, Colombia) por un periodo de 24 h. La muestra se sometió a lavados sucesivos con pequeñas cantidades de agua desionizada, retirando en cada caso el agua sobrenadante hasta obtener un pH constante; se secó en horno de secado Memmert modelo UNB a 378 K hasta peso constante; esta muestra se designó como GNA.
Caracterización del carbón activado
Las propiedades texturales de los carbones activados se determinaron a partir de las isotermas de adsorción de nitrógeno N2 a 77 K, obtenidas en un equipo Autosorb-iQ de Quantachrome equipado con el software AsiQwin IQ, una vez que las muestras fueran desgasificadas durante 5 h a 250 °C. El área superficial (S) se calculó utilizando el modelo BET (15); el volumen de microporo (Vo) se obtuvo a partir del modelo de Dubinin-Astakhov (DA) (16); el volumen total de poro (VT) mediante la Teoría de Funcionales de Densidad para Sólidos Enfriados (QSDFT) y el volumen de mesoporo (Vm) por diferencia entre el volumen total y el volumen de microporo (17). Adicionalmente, se realizó el análisis elemental orgánico en el analizador Thermo Scientific modelo CHNS Flash 2000.
Adsorción de 4-nitrofenol desde solución acuosa
Para construir la isoterma de adsorción, se prepararon diferentes soluciones de 4-nitrofenol (Reactivo Sigma Aldrich ≥ 99%), a partir de una solución stock de 2000 mg/L en el rango de 0,1 a 10 mmol·L-1. Se colocaron 50 mL de cada solución en una serie de frascos que contenían 0,1 g del carbón activado, incluyendo un blanco de carbón activado. Los frascos se almacenaron a temperatura de 291 K durante un periodo de 15 días, determinado previamente como el tiempo requerido para alcanzar condiciones de equilibrio. Luego, las muestras se filtraron usando papel de filtro grado 3hw y la concentración de 4-nitrofenol adsorbido se determinó por espectroscopía UV en un equipo Thermo Spectronic Genesys 5 a λmax = 316 nm. Las medidas se hicieron por duplicado.
La cantidad de 4-nitrofenol adsorbida en el equilibrio qe (mmol g-1) se calculó utilizando la ecuación [1]:

ecuación [1]
Donde C0 y Ce (mmol·L-1) son las concentraciones inicial y final de 4-nitrofenol en la solución; V es el volumen de la solución (L) y m es la masa de carbón activado (g).
Determinación de la capacidad de adsorción
Para describir los datos de adsorción a partir del modelo de Sips, ecuación [2], el modelo de Langmuir, ecuación [3] y el modelo de Langmuir-Freundlich ecuación [4] se utilizó el programa SigmaPlot 12 en la categoría Sigmoidal, Logistic, 3 Parameter. Se hizo la comparación de los resultados obtenidos con los calculados utilizando el programa Statistica 7.

ecuación [2]
Donde qe (mmol·g-1) es la cantidad adsorbida en el equilibrio, Ce (mmol·L-1) es la concentración del adsorbato en el equilibrio, q0 (mmol·g-1) es la capacidad máxima de adsorción de Sips, KS es la constante de equilibrio de Sips que se relaciona con la energía característica de los microporos y n es el exponente del modelo de Sips relacionado con la heterogeneidad del sistema.

ecuación [3]
Donde qe (mmol·g-1) es la cantidad adsorbida en el equilibrio, Ce (mmol·L-1) es la concentración del adsorbato en el equilibrio, q0 (mmol·g-1) es la capacidad máxima de adsorción de Langmuir y KL es el parámetro energético de Langmuir.

ecuación [4]
En donde q0 (mmol·g-1) corresponde a la cantidad máxima adsorbida en la monocapa Ce (mmol·L-1) es la concentración del adsorbato en el equilibrio y n se relaciona con la heterogeneidad energética del sistema al igual que en el modelo de Sips. La constante KLF que se relaciona con la energía característica del sistema equivale a la constante KS del modelo de Sips.
Resultados y discusión
Caracterización del carbón activado
En la Figura 1 se observan las isotermas de adsorción de nitrógeno a 77 K para las muestras en estudio y se puede apreciar que son tipo I, típicas de carbones principalmente microporosos con poca mesoporosidad de acuerdo con la clasificación de la IUPAC (18).
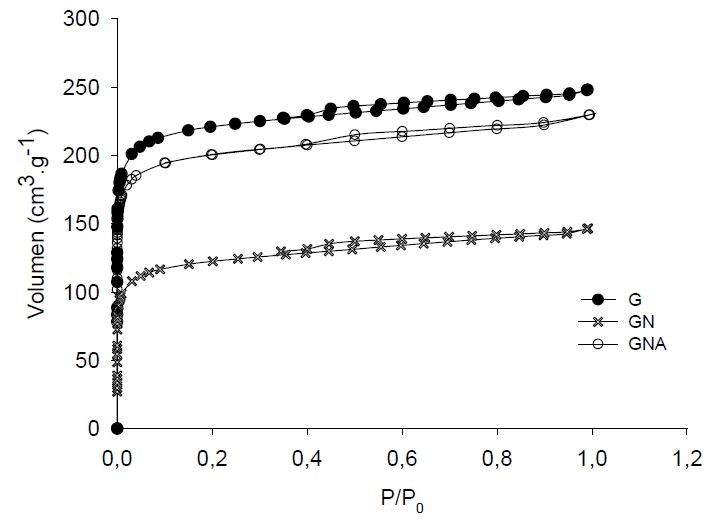
Figura 1
Figura 1.
Isotermas de adsorción de nitrógeno a 77 K para las muestras de carbón activado; G: Carbón activado granular Carbochem 850, GN: Carbón activado Carbochem 850 oxidado por impregnación con ácido nítrico, GNA: carbón activado GN funcionalizado con solución de NH4OH al 25% mediante reflujo
Se observa que la oxidación del carbón activado con ácido nítrico generó la disminución del volumen de nitrógeno adsorbido, no obstante, al someter la muestra oxidada a reflujo, se observa el aumento de este. Estos resultados sugieren que posiblemente parte del ácido nítrico utilizado en la oxidación del carbón activado quedó ocluido en algunos microporos impidiendo el acceso del nitrógeno y el tratamiento con hidróxido de amonio permitió recuperar esta microporosidad. En todo caso, se observa que los tratamientos realizados no destruyeron significativamente la microporosidad.
En la Tabla 1 se resumen los parámetros texturales determinados a partir de las isotermas de adsorción a 77 K; algunos de estos resultados han sido presentados con anterioridad (19).
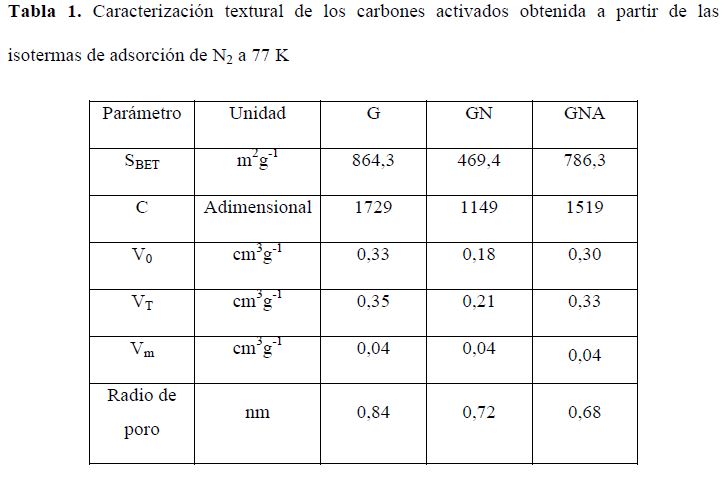
*Volumen de microporo, V0 calculado con el modelo de Dubinin-Astakhov. Volumen total de poro VT (QSDFT método Slit/cylindr, brazo de adsorción). Volumen de mesoporo por diferencia entre VT y el V0. G: Carbón activado granular Carbochem 850, GN: Carbón activado Carbochem 850 oxidado por impregnación con ácido nítrico, GNA: carbón activado GN funcionalizado con solución de NH4OH al 25% mediante reflujo.
En la Tabla 1 se observa cómo el ácido ocluido en los microporos de la muestra GN generó disminución del área y de la microporosidad del carbón activado en un 54%, disminución que se recuperó al tratar el carbón con hidróxido de amonio. También se observa que la mesoporosidad de los carbones es baja y que el radio de poro está por debajo de 2 nm, confirmando que se trata principalmente de carbones microporosos de acuerdo con la clasificación de la IUPAC (18).
En la Figura 2 se observan los resultados obtenidos aplicando la Teoría de Funcionales de Densidad para Sólidos Enfriados (QSDFT) que tiene en cuenta la heterogeneidad geométrica de la superficie. Para las muestras estudiadas los mejores resultados se obtuvieron asumiendo poros cilíndricos y en forma de rendija. Se encontró que los microporos se distribuyen en su mayoría alrededor de 0,4 nm y entre 0,5 y 0,7 nm; hay una pequeña cantidad de poros entre 1,0 y 1,2 nm. También se observa que la muestra oxidada presenta una disminución alta de los microporos que se encuentran alrededor de 0,4 nm y el tratamiento con hidróxido de amonio permite que se pueda acceder nuevamente a esta microporosidad como ya se mencionó.
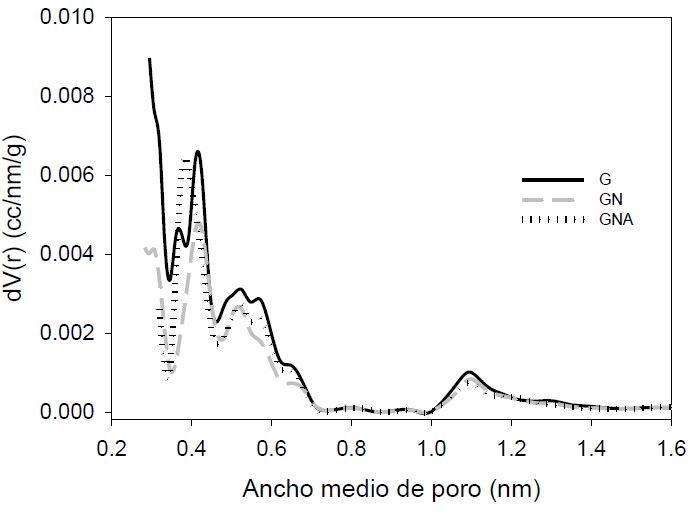
Figura 2.
Figura 2.
Distribución de tamaño de poro calculado con el modelo QSDFT G: Carbón activado granular Carbochem 850, GN: Carbón activado Carbochem 850 oxidado por impregnación con ácido nítrico, GNA: carbón activado GN funcionalizado con solución de NH4OH al 25% mediante reflujo
El contenido de nitrógeno en las muestras de carbón activado determinado por análisis elemental se muestra en la Figura 3.
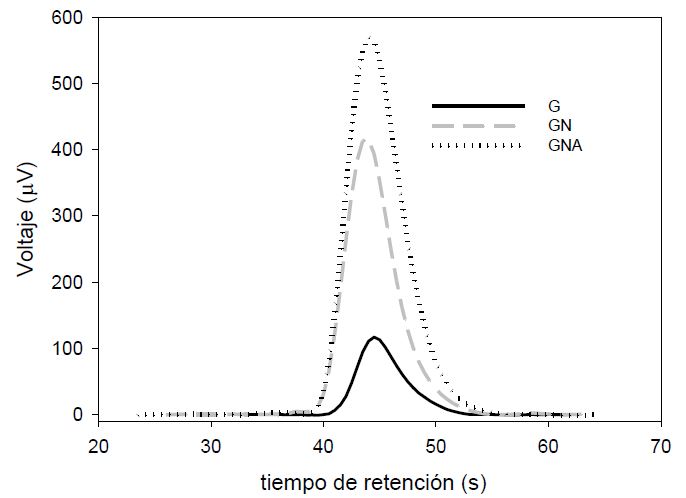
Figura 3.
Figura 3.
Señal de nitrógeno en las curvas potenciométricas obtenidas a partir del análisis elemental de los carbones activados. G: Carbón activado granular Carbochem 850, GN: Carbón activado Carbochem 850 oxidado por impregnación con ácido nítrico, GNA: carbón activado GN funcionalizado con solución de NH4OH al 25% mediante reflujo
En la Figura 3 se observa que la señal correspondiente al nitrógeno en la curva de análisis elemental para las muestras en estudio se incrementó para las muestras GN y GNA en relación con la muestra original G. Las áreas de integración obtenidas para el nitrógeno obtenidas fueron: G 5523 (μV.s), GN 21665 (μV.s) y GNA 33631 (μV.s). Se ha reportado que el tratamiento del carbón activado con reactivos que contienen nitrógeno a bajas temperaturas resulta en la formación de lactamas, iminas, amidas y aminas (20, 21).
Adsorción de 4-nitrofenol desde solución acuosa sobre el carbón activado
Los resultados de la adsorción de 4-nitrofenol sobre los carbones activados se pueden observar en la Figura 4.
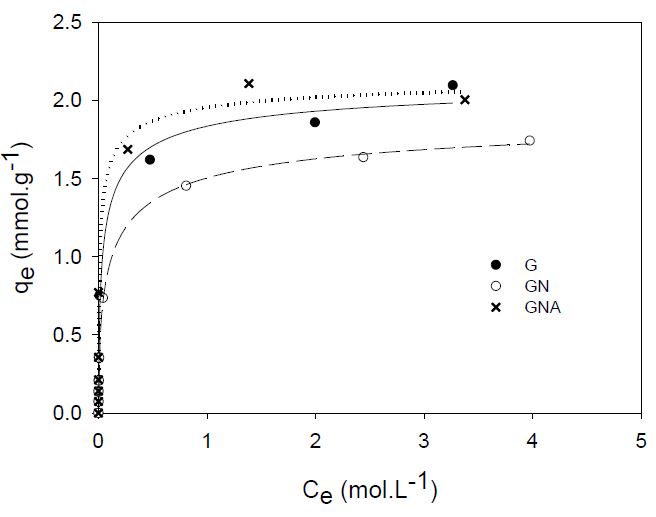
Figura 4.
Isoterma de adsorción de 4-nitrofenol sobre carbón activado sobre las muestras de carbón activado.
Figura 4. Isoterma de adsorción de 4-nitrofenol sobre carbón activado sobre las muestras de carbón activado. Las líneas corresponden al ajuste de los datos al modelo de Langmuir. G: Carbón activado granular Carbochem 850, GN: Carbón activado Carbochem 850 oxidado por impregnación con ácido nítrico, GNA: carbón activado GN funcionalizado con solución de NH4OH al 25% mediante reflujo
Para todas las muestras de carbón activado en estudio, se observa que en concentraciones menores a 0,01 mmol·L-1 de 4-nitrofenol en solución, la cantidad adsorbida qe aumenta rápidamente. Después, llega a un plato a partir del cual la cantidad adsorbida permanece casi constante a pesar del aumento del 4-nitrofenol en la solución, indicando que se ha llegado al punto de saturación de los sitios disponibles para la adsorción sobre la superficie del carbón activado. Este tipo de isoterma se asemeja a la tipo H de acuerdo con la clasificación realizada por Giles et al (22, 23) que sugiere que hay alta afinidad entre el adsorbente y el adsorbato, reflejada en la alta adsorción a bajas concentraciones y que se relaciona con la química superficial del carbón activado y su estructura microporosa.
Estudios reportados por Dabrowsky (23) muestran que la oxidación de la superficie del carbón activado con ácido nítrico, como la que se realizó en este estudio, aumenta el contenido de grupos carboxílicos e hidroxílicos sobre esta y que la presencia de estos grupos inhibe la adsorción del 4-nitrofenol.
El reflujo en solución de hidróxido de amonio al que se sometió la muestra oxidada permite incorporar nitrógeno como heteroátomo a la estructura carbonosa mediante la formación de grupos amida, lactamas, iminas y aminas (21) los cuales favorecieron la adsorción del 4-nitrofenol frente a los carbones activados G y GN. Esto debido a que el 4-nitrofenol al presentar un pKa de 7,15 a 25 °C más bajo en relación con el fenol (pKa 9,89 a 25 °C) tiene un carácter más ácido que este, debido al sustituyente nitro que es un grupo que atrae electrones y aumenta la estabilidad del ion fenóxido por deslocalización de la carga negativa (24).
Sin embargo, como se obtuvo un pH de 4,6 para la solución stock de 4-nitrofenol y entre 4,7 y 5,6 para las muestras preparadas en el equilibrio, a partir de la ecuación de Henderson-Hasselbalch se determinó que la concentración del ion 4-nitrofenóxido es 2,82 x 10-3 veces la concentración 4-nitrofenol, y por lo tanto, el reactivo se encuentra en su forma protonada. En cuanto a la superficie del carbón activado, a pH 4,6, se encuentra también protonada y la incorporación de grupos nitrogenados hace que sea mayor el grado de protonación en relación con las muestras G y GN. En estas condiciones, tanto el 4-nitrofenol como la superficie del carbón activado compiten por los protones disponibles y esto favorecería la interacción entre el carbón activado y el 4-nitrofenol por puentes de hidrógeno.
Determinación de la capacidad de adsorción
Para evaluar la adsorción de compuestos fenólicos sobre el carbón activado se han reportado estudios en los que los datos experimentales se ajustaron a los modelos de Freundlich o Langmuir. Se ha encontrado que, aunque estos son convenientes para la caracterización de los datos, tienen un potencial limitado a la predicción del comportamiento bajo condiciones dentro de los rangos de las mediciones experimentales, porque los supuestos de estos modelos no reflejan sustancialmente los procesos de adsorción (23).
El modelo Sips, mostrado en la ecuación [2], también ha sido utilizado para describir los datos de adsorción desde solución acuosa con resultados satisfactorios; en forma general, este modelo se asemeja al de Langmuir, ecuación [3], pero a diferencia de este, el modelo de Sips presenta el parámetro n. Cuando el valor de n es igual a 1, el modelo de Sips toma la forma del modelo de Langmuir.
Teniendo en cuenta que el modelo de Langmuir asume que todos los sitios de adsorción sobre la superficie del carbón activado son energéticamente equivalentes, se puede deducir que el parámetro n en el modelo de Sips está asociado a la heterogeneidad energética del sistema adsorbente-adsorbato, que puede provenir del adsorbente, del adsorbato o de una combinación de estas (11). Por lo tanto, cuando este parámetro se aproxima a 1 se puede sugerir que el sistema es energéticamente homogéneo mientras que a medida que n se aleja de 1 el sistema adsorbente-adsorbato es energéticamente heterogéneo.
Ahora bien, cuando Ce en la solución es baja, el término KSCe1/n en el modelo de Sips es pequeño y la suma de 1+ KSCe 1/n en el denominador tiende a 1. Entonces el modelo se transforma en [5]:

ecuación [5]
La ecuación [5] presenta la misma forma del modelo de Freundlich y, en ese caso, el producto de la cantidad adsorbida en monocapa q0 por la constante de Sips KS, relacionada con la energía característica del sistema, corresponde a la constante KF de la ecuación de Freundlich.
La ecuación [6] en SigmaPlot 12 que permite calcular los parámetros del modelo de Sips se incluye en la categoría Sigmoidal, Logistic, 3 Parameter:

ecuación [6]
que de acuerdo con la descripción de Wu et al (12), los correspondientes con el modelo de Sips son: y = qe, b = -1/n, a = qo, x0 = 1/KS, x = Ce.
Los parámetros resultantes del ajuste de los datos de adsorción de 4-nitrofenol sobre carbón activado al modelo de Sips utilizando el programa SigmaPlot, en la categoría Sigmoidal, Logistic, 3 Parameter se resumen en la Tabla 2. Con propósitos comparativos, estos mismos parámetros se calcularon utilizando el programa Statistica 7. Los datos de adsorción también se ajustaron al modelo de Langmuir utilizando el programa Statistica 7 con el fin de ver las diferencias entre los parámetros de cubrimiento y los parámetros energéticos de cada modelo. Todos estos valores también se presentan en la Tabla 2.

Parámetros del modelo de Sips y Langmuir para la adsorción de 4-nitrofenol sobre carbón activado obtenidos con los programas SigmaPlot 12 y Statistica 7
En la Tabla 2 se observa que los valores para los parámetros q0 y n del modelo de Sips presentan los mismos valores calculados con los programas SigmaPlot y Statistica 7, no obstante, se obtiene una diferencia significativa para el parámetro KS.
A partir del modelo de Sips se tiene que al dividir el numerador y el denominador de la ecuación entre KSCe 1/n la ecuación se transforma en [7]:

ecuación [7]
que también puede escribirse como [8]:

ecuación [8]
La ecuación [6] que corresponde a la fórmula Sigmoidal, Logistic, 3 Parameter de SigmaPlot también se puede escribir como [9]:
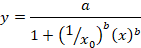
ecuación [9]
Comparando las ecuaciones [8] y [9] se tiene que y = qe, b = -1/n, a = qo, x = Ce, de acuerdo a lo reportado en la literatura (12), pero se tiene, según la ecuación [10], lo siguiente:

ecuación [10]
y por lo tanto, la ecuación [11]:

ecuación [11]
Utilizando la ecuación [10] para calcular el valor de KS a partir del valor de x0 obtenido con la ecuación Sigmoidal, Logistic, 3 Parameter de SigmaPlot 12, se obtiene el valor de 8,3354 para la muestra GNA, valor que concuerda con el obtenido utilizando el programa Statistica 7.
Al dividir el numerador y el denominador del modelo de Langmuir-Freundlich ecuación [4] entre (KLFCe)1/n se obtiene [13]:

ecuación [13]
o escrito de otra forma se obtiene [14]:

ecuación [14]
De acuerdo como se reporta en la literatura (12) y comparando las ecuaciones [14] y [9], se observa que los parámetros qe, q0, n y Ce corresponden a y, a , -1/b y x, respectivamente. En cuanto al parámetro KLF se tiene [15]:

ecuación [15]
Y como b = -1/n, entonces se obtiene [16]:

ecuación [16]
Por tanto, los valores reportados por Wu et al. (12) para el ajuste de los datos utilizando el programa SigmaPlot no corresponden al modelo de Sips sino al modelo de Langmuir-Freundlich.
Otro punto a analizar es el valor de los parámetros energéticos obtenidos por cada uno de estos modelos, comparados en la Figura 5.
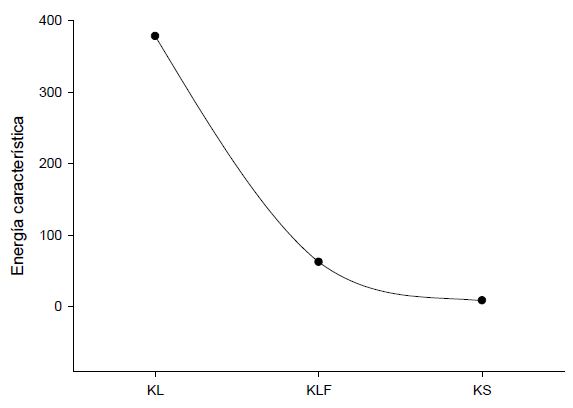
Figura 5
Figura 5.
Parámetros energéticos para los modelos de Langmuir (KL, L.mmol-1), Langmuir-Freundlich (KLF, L.mmo-1) y Sips (KS, (L.mmol-1)1/n)
En la Figura 5 se puede observar la diferencia en los valores del parámetro energético para los modelos comparados. Esto demuestra que, aunque los modelos de Sips y Langmuir- Freundlich son parecidos, difieren en este parámetro. El valor obtenido para el parámetro energético KL en el modelo de Langmuir es el más alto. Se debe tener en cuenta que este modelo matemático, al no contemplar la heterogeneidad energética del carbón activado, describe todos los sitios sobre la superficie como puntos de adsorción equivalentes. Según esto, la adsorción se llevaría a cabo de manera uniforme y, por lo tanto, la sumatoria de la energía producida en cada sitio por la adsorción daría como resultado un valor alto. Por el contrario, para la constante calculada con el modelo de Sips (KS) se obtuvo el valor más bajo que, al considerar la heterogeneidad energética de la superficie, indica que la adsorción solo se realiza sobre algunos sitios. Así, comparando el ajuste de los datos a los modelos de Langmuir y Sips mediante el valor de R, se observa que los datos presentan un mejor ajuste al modelo de Sips lo cual confirma que la superficie del carbón activado estudiado es heterogénea.
Finalmente, en la Tabla 3 se presenta el ajuste de los datos de adsorción de 4-nitrofenol al modelo de Sips utilizando el programa SigmaPlot 12 con la ecuación Sigmoidal Logistic 3 Parmeter, utilizando la ecuación [11] para el cálculo del párametro KS.
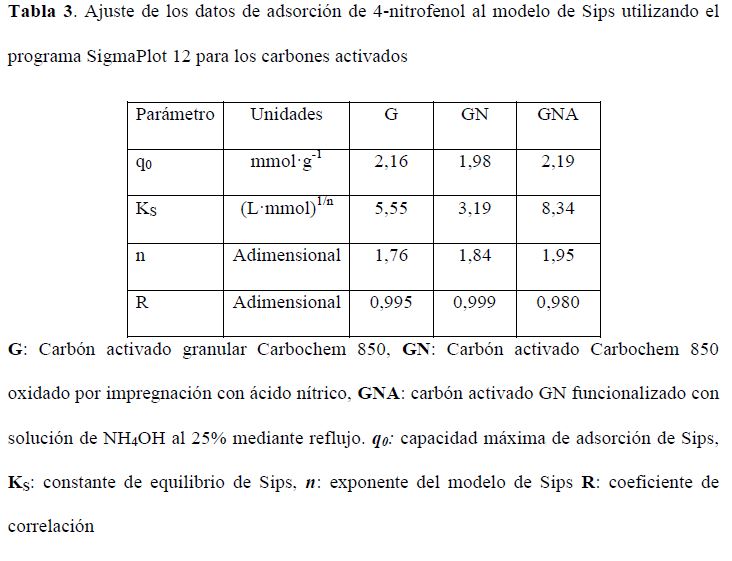
Ajuste de los datos de adsorción de 4-nitrofenol al modelo de Sips utilizando el programa SigmaPlot 12 para los carbones activados
G: Carbón activado granular Carbochem 850, GN: Carbón activado Carbochem 850 oxidado por impregnación con ácido nítrico, GNA: carbón activado GN funcionalizado con solución de NH4OH al 25% mediante reflujo. q0: capacidad máxima de adsorción de Sips, KS: constante de equilibrio de Sips, n: exponente del modelo de Sips R: coeficiente de correlaciónEn la Tabla 3 se puede observar que el valor para la constante KS relacionada con la energía adsorbente-adsorbato presenta el valor más alto en la adsorción sobre el carbón con mayor contenido de grupos nitrogenados en la superficie GNA y el valor más bajo en el carbón activado con mayor contenido de grupos ácidos sobre esta. Estos resultados confirman que la adsorción del compuesto fenólico se favorece con el incremento de grupos nitrogenados sobre la superficie, mientras que se desfavorece por la presencia de grupos ácidos sobre esta. En cuanto al parámetro n relacionado con la heterogeneidad del sistema, se observa que este se incrementa con el tratamiento con ácido nítrico y aún más con la presencia de grupos nitrogenados en la superficie del carbón activado.
Conclusiones
La impregnación del carbón activado con solución concentrada de ácido nítrico y posterior reflujo en hidróxido de amonio introduce nitrógeno a la estructura carbonosa como heteroátomo sobre la superficie. Los grupos nitrogenados sobre la superficie del carbón activado, favorecen la adsorción del 4-nitrofenol al incrementar la capacidad de protonación del carbón activado y por lo tanto, la formación de puentes de hidrógeno. La adsorción del 4-nitrofenol sobre el carbón activado describe una isoterma tipo H característica de fuertes interacciones adsorbente-adsorbato.
Adicionalmente, el modelo de Langmuir, al no considerar la heterogeneidad energética del sistema adsorbente-adsorbato, genera valores altos para el parámetro KL relacionado con la energía característica del sistema. Por el contrario, el modelo de Sips, debido a que contempla la heterogeneidad energética del sistema adsorbente-adsorbato, presenta un valor bajo para el parámetro energético KS.
El ajuste de los datos de adsorción a los modelos de Sips y Langmuir-Freundlich permite obtener los mismos valores para la adsorción en monocapa q0 y para el parámetro relacionado con la heterogeneidad del sistema n, mientras que se presentan diferencias en los valores obtenidos para los parámetros KS y KLF relacionados con la energía característica de los microporos.
El parámetro KS del modelo de Sips, relacionado con la energía del sistema adsorbente-adsorbato, en la ecuación Sigmoidal, Logistic, 3 Parameter del programa SigmaPlot es igual a (1/x0)-b. Sin embargo, el parámetro KLF del modelo Langmuir-Freundlich, relacionado también con la energía del sistema adsorbente-adsorbato, es igual a 1/x0 en la ecuación Sigmoidal, Logistic, 3 Parameter del programa SigmaPlot.
Agradecimientos
Los autores agradecen al convenio Marco entre la Universidad de Los Andes y la Universidad Nacional de Colombia y al acta de acuerdo establecido por los Departamentos de Química de ambas universidades.
Referencias
1. Marsh, H.; Rodríguez-Reinoso, F. Porosity in Carbons: Modeling. In Activated Carbon, Elsevier Science Ltd: Oxford, 2006; pp 87-142. DOI: https://doi.org/10.1016/B978-008044463-5/50018-2.
2. Caturla, F.; Martín-Martínez, J. M.; Molina-Sabio, M.; Rodriguez-Reinoso, F.; Torregrosa, R. Adsorption of substituted phenols on activated carbon. J. Colloid Interface Sci. 1988, 124 (2), 528-534. DOI: https://doi.org/10.1016/0021-9797(88)90189-0.
3. Racovita, S.; Vlad, C. D.; Radu, C. D.; Vasiliu, S.; Plesca, I.; Branisteanu, D. E.; Sandu, I. C. A. Equilibrium and Kinetics Studies of 4-nitrophenol Adsorption Onto Porous Crosslinked Beads. Mater. Plast. 2016, 53 (3), 434-439. DOI: https://doi.org/10.7508/gjesm.2016.01.002.
4. Sostenible, M. d. M. A. y. D. Resolución 0631 del 17 de marzo de 2015. 2015, 62. Disponible en: http://www.lasalle.edu.co/wps/wcm/connect/7bf35b9e-b9ac-45b3-a280-c7dec8b1499d/Resolucion+631-2015.pdf?MOD=AJPERES.
5. Liu, B.; Li, Y.; Gai, X.; Yang, R.; Mao, J.; Shan, S. Exceptional Adsorption of Phenol and p-Nitrophenol from Water on Carbon Materials Prepared via Hydrothermal Carbonization of Corncob Residues. BioResources 2016, 11 (3), 7566-7579. DOI: https://doi.org/10.15376/biores.11.3.7566-7579.
6. Álvarez-Torrellas, S.; Martin-Martinez, M.; Gomes, H.; Ovejero, G.; García, J. Enhancement of p-nitrophenol adsorption capacity through N 2-thermal-based treatment of activated carbons. Appl. Surf. Sci. 2017, 414, 424-434. DOI: https://doi.org/10.1016/j.apsusc.2017.04.054.
7. Dhorabe, P. T.; Lataye, D. H.; Ingole, R. S. Removal of 4-nitrophenol from aqueous solution by adsorption onto activated carbon prepared from Acacia glauca sawdust. Water Sci. Technol.2016, 73 (4), 955-966. DOI: https://doi.org/10.2166/wst.2015.575.
8. Matus, C.; Camú, E.; Villarroel, M.; Ojeda, J.; Baeza, P. Study of the removal of 4-nitrophenol from aqueous media by adsorption on different materials. J. Chil. Chem. Soc. 2016, 61 (1), 2832-2836. DOI: https://doi.org/10.4067/S0717-97072016000100017.
9. Rincón-Silva, N. G.; Moreno-Piraján, J. C.; Giraldo, L. Equilibrium, kinetics and thermodynamics study of phenols adsorption onto activated carbon obtained from lignocellulosic material (Eucalyptus Globulus labill seed). Adsorption 2016, 22 (1), 33-48. DOI: https://doi.org/10.1007/s10450-015-9724-2.
10. Sips, R. On the Structure of a Catalyst Surface. II. J. Chem. Phys.s 1950, 18 (8), 1024-1026. DOI: https://doi.org/10.1063/1.1747848.
11. Do, D. D., Adsorption Analysis: Equilibria and Kinetics. World Scientific: 1998; Vol. 2.
12. Wu, F.-C.; Wu, P.-H.; Tseng, R.-L.; Juang, R.-S. Use of refuse-derived fuel waste for the adsorption of 4-chlorophenol and dyes from aqueous solution: Equilibrium and kinetics. J. Taiwan Inst. Chem. Eng. 2014, 45 (5), 2628-2639. DOI: https://doi.org/10.1016/j.jtice.2014.07.007.
13. Hamdaoui, O.; Naffrechoux, E. Modeling of adsorption isotherms of phenol and chlorophenols onto granular activated carbon: Part II. Models with more than two parameters. J. Hazard. Mater. 2007, 147 (1–2), 401-411. DOI: https://doi.org/10.1016/j.jhazmat.2007.01.021.
14. Foo, K.; Hameed, B. Insights into the modeling of adsorption isotherm systems. Chem. Eng. J. 2010, 156 (1), 2-10. DOI: https://doi.org/10.1016/j.cej.2009.09.013.
15. Brunauer, S.; Emmett, P. H.; Teller, E. Adsorption of gases in multimolecular layers. J. Amer. Chem. Soc. 1938, 60 (2), 309-319. DOI: https://doi.org/10.1021/ja01269a023.
16. Dubinin, M.; Radushkevich, L. Equation of the characteristic curve of activated charcoal. Chem. Zentr. 1947, 1 (1), 875. DOI: https://doi.org/10.1016/0008-6223(89)90078-X.
17. Vargas, D. P.; Giraldo, L.; Moreno-Piraján, J. C. CO(2) Adsorption on Activated Carbon Honeycomb-Monoliths: A Comparison of Langmuir and Tóth Models. Int. J. Mol. Sci. 2012, 13 (7), 8388-8397. DOI: https://doi.org/10.3390/ijms13078388.
18. Thommes, M.; Kaneko, K.; Neimark, A. V.; Olivier, J. P.; Rodriguez-Reinoso, F.; Rouquerol, J.; Sing, K. S. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure Appl. Chem. 2015, 87 (9-10), 1051-1069. DOI: https://doi.org/10.1515/pac-2014-1117.
19. Carvajal-Bernal, A. M.; Gómez-Granados, F.; Giraldo, L.; Moreno-Piraján, J. C. Calorimetric evaluation of activated carbons modified for phenol and 2,4-dinitrophenol adsorption. Adsorption 2016, 22 (1), 13-21. DOI: https://doi.org/10.1007/s10450-015-9725-1.
20. Bandosz, T. J. Activated carbon surfaces in environmental remediation. Academic press: 2006; Vol. 7.
21. Jansen, R.; Van Bekkum, H. Amination and ammoxidation of activated carbons. Carbon 1994, 32 (8), 1507-1516. DOI: https://doi.org/10.1016/0008-6223(94)90146-5.
22. Giles, C. H.; MacEwan, T. H.; Nakhwa, S. N.; Smith, D. 786. Studies in adsorption. Part XI. A system of classification of solution adsorption isotherms, and its use in diagnosis of adsorption mechanisms and in measurement of specific surface areas of solids. J. Chem. Soc. (Resumed) 1960, (0), 3973-3993. DOI: https://10.1039/JR9600003973.
23. Dąbrowski, A.; Podkościelny, P.; Hubicki, Z.; Barczak, M. Adsorption of phenolic compounds by activated carbon—a critical review. Chemosphere 2005, 58 (8), 1049-1070. DOI: https://doi.org/10.1016/j.chemosphere.2004.09.067.
24. Mcmurry, J. Química Orgánica. Cengage Learning Editores: México; 2001.
Enlace alternativo
https://revistas.unal.edu.co/index.php/rcolquim/article/view/64561 (html)
Recibido: 19 de abril de 2017; Aceptado: 27 de junio de 2017
Resumen
Se evaluó la aminación de un carbón activado preoxidado con ácido nítrico en la adsorción de 4-nitrofenol. Se aplicó el modelo de Sips a la adsorción desde solución acuosa, utilizando Sigmoidal Logistic 3 Parameter del programa SigmaPlot 12. Los parámetros obtenidos se compararon con los calculados con el programa Statistica 7 para los modelos de Sips y Langmuir. Se encontró que la modificación realizada sobre el carbón activado incrementó la adsorción de 4-nitrofenol de 2,16 a 2,19 mmol·g-1, aumentando, a su vez, la afinidad adsorbente-adsorbato. El parámetro para la energía característica del sistema determinado con el modelo de Langmuir toma un valor de 377,47 L·mmol-1 al no considerar la heterogeneidad energética, mientras que a partir del modelo de Sips se presenta un valor de 8,32 (L·mmol-1)1/n. Adicionalmente, se encontró que en la ecuación matemática Sigmoidal Logistic 3 Parameter del programa SigmaPlot el valor de 1/x0 corresponde a la constante KLF del modelo Langmuir-Freundlich, mientras que el valor del parámetro KS del modelo de Sips es igual a (1/x0)-b. Se concluye que la adsorción de 4-nitrofenol sobre el carbón activado se favorece por el incremento de grupos nitrogenados sobre su superficie.
Palabras clave
Sips, Langmuir, carbón activado, adsorción, 4-nitrofenol, SigmaPlot.Abstract
The amination of a nitric acid pre oxidized activated carbon in the adsorption of 4-nitrophenol was evaluated. The Sips model application to the aqueous solution adsorption data, using Sigmoidal Logistic 3 Parameter formula, in the SigmaPlot 12 program was applied. The obtained parameters were compared with those calculated with Statistica 7 program for Sips and Langmuir models. It was found that the activated carbon increases the adsorption from 2.16 to 2.19 mmol·g-1, showing good adsorbent-adsorbate affinity. The system´s characteristic energy parameter calculated with the Langmuir model was 377.47 L·mmol-1, when not considering energy heterogeneity, while from the Sips model was 8.32 (L.mmol-1)1/n. Additionally, it was found that in the mathematical equation Sigmoidal Logistic 3 Parameter of the SigmaPlot program, the 1/x0 value corresponds to the Langmuir-Freundlich model constant KLF, while the parameter value KS in the Sips model is equal to (1/x0)-b in this program. It was concluded that the 4-nitrophenol adsorption on activated carbon is favored by the presence of nitrogen groups on their activated carbon surface.
Keywords
Sips, Langmuir, Adsorption, Activated carbon, 4-nitrophenol, SigmaPlot.Resumo
Foi avaliada a aminação de um carvão ativado preoxidado com ácido nítrico na adsorção do 4-nitrofenol. Foi aplicado o modelo de Sips à adsorção desde solução aquosa usando Logística Sigmoidal 3 do programa Sigmaplot 12. Os parâmetros obtidos foram comparados com os calculados com o programa Statistica 7, para os modelos de Sips e Langmuir. Foi encontrado que a modificação do carvão ativado incrementou a adsorção de 4-nitrofenol de 2,16 até 2,19 mmol·g-1, acrescentando a afinidade adsorvente-adsorvato. O parâmetro para a energia característica do sistema calculado com o modelo Langmuir teve um valor de 377,47 L·mmol-1 porque não considerou a heterogeneidade energética, enquanto que no modelo de Sips este parâmetro teve um valor de 8,32 (L·mmol-1)1/n. Além disso, foi encontrado que na equação matemática Sigmoidal Logistic 3 Parameter do programa Sigmaplot 3 o valor de 1/x0 corresponde à constante KLF do modelo Langmuir-Freundlich, enquanto o valor do parâmetro KS do modelo de Sips é igual a (1/x0)-b. Conclui-se que a adsorção do 4-nitrofenol sobre carvão ativado é favorecida pela presença de grupos nitrogenado na superfície destes.
Palavras-chave
Sips, Langmuir, carvão ativado, adsorção, 4-nitrofenol, programa SigmaPlot.Introducción
El carbón activado es uno de los sólidos adsorbentes más complejos y, al mismo tiempo, más versátil dentro de la industria. Proviene de materiales no grafitizables y, aunque no posee una estructura amorfa, exhibe un desorden estructural considerable que le proporciona porosidad y química superficial, lo cual lo convierte en un excelente material en los procesos de adsorción (1, 2). Por tanto, se ha utilizado en la remoción de contaminantes mediante el proceso de adsorción desde fase acuosa, los cuales son difíciles y costosos de remover como el 4-nitrofenol, catalogado por la US Enviromental Protection Agency (EPA) como tóxico, no degradable y bioacumulativo (3); este no se permite en concentraciones mayores a 0,02 mg·kg-1 en aguas para vertimiento al alcantarillado (4, 5).
El 4-nitrofenol es un contaminante producido en procesos químicos como el fraccionamiento del petróleo, producción de caucho, tratamiento de madera, tratamiento de pulpa de papel, producción de pinturas y plásticos, entre otros (6). Muchos de estos productos una vez utilizados, son liberados a las fuentes de agua y pueden permanecer allí después del tratamiento primario (7, 8), por tanto, se recurre a la adsorción sobre carbón activado para retirarlo (3).
La isoterma de adsorción permite determinar tanto la capacidad de adsorción del carbón activado como las interacciones energéticas que se presentan en el sistema y que dependen de las características tanto químicas como geométricas del adsorbente así como de la afinidad entre este y el adsorbato o el agua (9).
El estudio del proceso de adsorción desde solución se realiza mediante la aplicación de distintos modelos a las isotermas de adsorción, los cuales permiten describir los datos experimentales. Uno de estos modelos fue desarrollado por Sips en 1948 (10), este es un modelo empírico igual que el de Freundlich, y en su forma matemática es similar al modelo de Langmuir, no obstante, el de Sips presenta un límite finito cuando la concentración del soluto en la fase acuosa es suficientemente alta (11). El modelo de Sips también es conocido como el modelo Langmuir-Freundlich (13), no obstante, este último presenta una modificación respecto al modelo de Sips.
Para realizar el ajuste de los datos experimentales de adsorción a un modelo, se utilizan habitualmente programas de optimización no lineal dentro de los cuales se ha reportado el uso de MatLab, Statistica y SigmaPlot entre otros (11, 12).
Las ecuaciones de Langmuir y Freundlich pueden ajustarse fácilmente a una recta porque son modelos muy utilizados para describir los datos de adsorción. No obstante, no ofrecen una imagen general del proceso de adsorción. En la actualidad el uso de cálculos computacionales y estadísticos permite el ajuste de los datos de adsorción a modelos de más de dos parámetros como es el caso del modelo de Sips que, de acuerdo con otros estudios reportados (13, 14), describe mejor los datos de adsorción en un amplio rango de concentraciones.
El programa comercial SigmaPlot 12 contiene las ecuaciones correspondientes al modelo no lineal de Sips. Este programa proporciona los parámetros de ajuste a la isoterma y, además, los errores estadísticos del ajuste de los datos experimentales al modelo incluyendo los coeficientes de correlación R y R2, el error estándar SE, F-test y los valores de P, que permiten evaluar el grado de ajuste de los datos al modelo teórico (12).
El objetivo de este estudio fue evaluar el efecto de la modificación de un carbón activado mediante la introducción de grupos nitrogenados a un carbón activado preoxidado, en la adsorción de 4-nitrofenol desde solución acuosa. Adicionalmente, tomando como base la descripción que realizan Wu et al (12) sobre el uso del programa SigmaPlot en la categoría Sigmoidal, Logistic, 3 Parameter para el ajuste de los datos de adsorción de 4-clorofenol y colorantes desde solución acuosa al modelo de Sips, se analizó la descripción matemática de este programa, con el fin de aportar al ajuste de los datos de adsorción obtenidos en este estudio mediante el modelo de Sips.
Materiales y métodos
Preparación del carbón activado
Como material de partida se utilizó el carbón activado granular comercial, Carbochem 850 (Pensilvania, US), producido a partir de cáscara de coco (muestra G). Se modificó por impregnación con una solución de ácido nítrico al 60% p/p (preparado a partir de ácido nítrico Reactivo Merck 65% p.a., Colombia) en una relación de carbón activado a agente impregnante de 1:3 p/p (muestra GN). La impregnación se hizo a temperatura de 291 K, la muestra se mantuvo a esta temperatura durante 72 h; después se lavó con agua desionizada hasta pH constante. Posteriormente, la muestra se colocó en reflujo en solución al 25% p/p de hidróxido de amonio (Reactivo Merck, Colombia) por un periodo de 24 h. La muestra se sometió a lavados sucesivos con pequeñas cantidades de agua desionizada, retirando en cada caso el agua sobrenadante hasta obtener un pH constante; se secó en horno de secado Memmert modelo UNB a 378 K hasta peso constante; esta muestra se designó como GNA.
Caracterización del carbón activado
Las propiedades texturales de los carbones activados se determinaron a partir de las isotermas de adsorción de nitrógeno N2 a 77 K, obtenidas en un equipo Autosorb-iQ de Quantachrome equipado con el software AsiQwin IQ, una vez que las muestras fueran desgasificadas durante 5 h a 250 °C. El área superficial (S) se calculó utilizando el modelo BET (15); el volumen de microporo (Vo) se obtuvo a partir del modelo de Dubinin-Astakhov (DA) (16); el volumen total de poro (VT) mediante la Teoría de Funcionales de Densidad para Sólidos Enfriados (QSDFT) y el volumen de mesoporo (Vm) por diferencia entre el volumen total y el volumen de microporo (17). Adicionalmente, se realizó el análisis elemental orgánico en el analizador Thermo Scientific modelo CHNS Flash 2000.
Adsorción de 4-nitrofenol desde solución acuosa
Para construir la isoterma de adsorción, se prepararon diferentes soluciones de 4-nitrofenol (Reactivo Sigma Aldrich ≥ 99%), a partir de una solución stock de 2000 mg/L en el rango de 0,1 a 10 mmol·L-1. Se colocaron 50 mL de cada solución en una serie de frascos que contenían 0,1 g del carbón activado, incluyendo un blanco de carbón activado. Los frascos se almacenaron a temperatura de 291 K durante un periodo de 15 días, determinado previamente como el tiempo requerido para alcanzar condiciones de equilibrio. Luego, las muestras se filtraron usando papel de filtro grado 3hw y la concentración de 4-nitrofenol adsorbido se determinó por espectroscopía UV en un equipo Thermo Spectronic Genesys 5 a λmax = 316 nm. Las medidas se hicieron por duplicado.
La cantidad de 4-nitrofenol adsorbida en el equilibrio qe (mmol g-1) se calculó utilizando la ecuación [1]:
ecuación [1]:
Donde C0 y Ce (mmol·L-1) son las concentraciones inicial y final de 4-nitrofenol en la solución; V es el volumen de la solución (L) y m es la masa de carbón activado (g).
Determinación de la capacidad de adsorción
Para describir los datos de adsorción a partir del modelo de Sips, ecuación [2], el modelo de Langmuir, ecuación [3] y el modelo de Langmuir-Freundlich ecuación [4] se utilizó el programa SigmaPlot 12 en la categoría Sigmoidal, Logistic, 3 Parameter. Se hizo la comparación de los resultados obtenidos con los calculados utilizando el programa Statistica 7.
ecuación [2]:
Donde qe (mmol·g-1) es la cantidad adsorbida en el equilibrio, Ce (mmol·L-1) es la concentración del adsorbato en el equilibrio, q0 (mmol·g-1) es la capacidad máxima de adsorción de Sips, KS es la constante de equilibrio de Sips que se relaciona con la energía característica de los microporos y n es el exponente del modelo de Sips relacionado con la heterogeneidad del sistema.
ecuación [3]:
Donde qe (mmol·g-1) es la cantidad adsorbida en el equilibrio, Ce (mmol·L-1) es la concentración del adsorbato en el equilibrio, q0 (mmol·g-1) es la capacidad máxima de adsorción de Langmuir y KL es el parámetro energético de Langmuir.
ecuación [4]:
En donde q0 (mmol·g-1) corresponde a la cantidad máxima adsorbida en la monocapa Ce (mmol·L-1) es la concentración del adsorbato en el equilibrio y n se relaciona con la heterogeneidad energética del sistema al igual que en el modelo de Sips. La constante KLF que se relaciona con la energía característica del sistema equivale a la constante KS del modelo de Sips.
Resultados y discusión
Caracterización del carbón activado
En la Figura 1 se observan las isotermas de adsorción de nitrógeno a 77 K para las muestras en estudio y se puede apreciar que son tipo I, típicas de carbones principalmente microporosos con poca mesoporosidad de acuerdo con la clasificación de la IUPAC (18).
Figura 1: Figura
1.
Se observa que la oxidación del carbón activado con ácido nítrico generó la disminución del volumen de nitrógeno adsorbido, no obstante, al someter la muestra oxidada a reflujo, se observa el aumento de este. Estos resultados sugieren que posiblemente parte del ácido nítrico utilizado en la oxidación del carbón activado quedó ocluido en algunos microporos impidiendo el acceso del nitrógeno y el tratamiento con hidróxido de amonio permitió recuperar esta microporosidad. En todo caso, se observa que los tratamientos realizados no destruyeron significativamente la microporosidad.
En la Tabla 1 se resumen los parámetros texturales determinados a partir de las isotermas de adsorción a 77 K; algunos de estos resultados han sido presentados con anterioridad (19).
*Volumen de microporo, V0
calculado con el modelo de Dubinin-Astakhov. Volumen total de poro VT
(QSDFT método Slit/cylindr, brazo de adsorción). Volumen de mesoporo por
diferencia entre VT y el V0.
G:
Carbón activado granular Carbochem 850, GN:
Carbón activado Carbochem 850 oxidado por impregnación con ácido nítrico, GNA: carbón activado GN funcionalizado con solución de NH4OH al 25% mediante reflujo.Tabla 1: Tabla
1.
Caracterización textural de los carbones activados obtenida a partir de las
isotermas de adsorción de N2 a 77 K
En la Tabla 1 se observa cómo el ácido ocluido en los microporos de la muestra GN generó disminución del área y de la microporosidad del carbón activado en un 54%, disminución que se recuperó al tratar el carbón con hidróxido de amonio. También se observa que la mesoporosidad de los carbones es baja y que el radio de poro está por debajo de 2 nm, confirmando que se trata principalmente de carbones microporosos de acuerdo con la clasificación de la IUPAC (18).
En la Figura 2 se observan los resultados obtenidos aplicando la Teoría de Funcionales de Densidad para Sólidos Enfriados (QSDFT) que tiene en cuenta la heterogeneidad geométrica de la superficie. Para las muestras estudiadas los mejores resultados se obtuvieron asumiendo poros cilíndricos y en forma de rendija. Se encontró que los microporos se distribuyen en su mayoría alrededor de 0,4 nm y entre 0,5 y 0,7 nm; hay una pequeña cantidad de poros entre 1,0 y 1,2 nm. También se observa que la muestra oxidada presenta una disminución alta de los microporos que se encuentran alrededor de 0,4 nm y el tratamiento con hidróxido de amonio permite que se pueda acceder nuevamente a esta microporosidad como ya se mencionó.
Figura
2. : Figura
2.
El contenido de nitrógeno en las muestras de carbón activado determinado por análisis elemental se muestra en la Figura 3.
Figura
3.: Figura
3.
En la Figura 3 se observa que la señal correspondiente al nitrógeno en la curva de análisis elemental para las muestras en estudio se incrementó para las muestras GN y GNA en relación con la muestra original G. Las áreas de integración obtenidas para el nitrógeno obtenidas fueron: G 5523 (μV.s), GN 21665 (μV.s) y GNA 33631 (μV.s). Se ha reportado que el tratamiento del carbón activado con reactivos que contienen nitrógeno a bajas temperaturas resulta en la formación de lactamas, iminas, amidas y aminas (20, 21).
Adsorción de 4-nitrofenol desde solución acuosa sobre el carbón activado
Los resultados de la adsorción de 4-nitrofenol sobre los carbones activados se pueden observar en la Figura 4.
Figura
4.: Isoterma de adsorción de 4-nitrofenol sobre carbón activado sobre las muestras
de carbón activado.
Para todas las muestras de carbón activado en estudio, se observa que en concentraciones menores a 0,01 mmol·L-1 de 4-nitrofenol en solución, la cantidad adsorbida qe aumenta rápidamente. Después, llega a un plato a partir del cual la cantidad adsorbida permanece casi constante a pesar del aumento del 4-nitrofenol en la solución, indicando que se ha llegado al punto de saturación de los sitios disponibles para la adsorción sobre la superficie del carbón activado. Este tipo de isoterma se asemeja a la tipo H de acuerdo con la clasificación realizada por Giles et al (22, 23) que sugiere que hay alta afinidad entre el adsorbente y el adsorbato, reflejada en la alta adsorción a bajas concentraciones y que se relaciona con la química superficial del carbón activado y su estructura microporosa.
Estudios reportados por Dabrowsky (23) muestran que la oxidación de la superficie del carbón activado con ácido nítrico, como la que se realizó en este estudio, aumenta el contenido de grupos carboxílicos e hidroxílicos sobre esta y que la presencia de estos grupos inhibe la adsorción del 4-nitrofenol.
El reflujo en solución de hidróxido de amonio al que se sometió la muestra oxidada permite incorporar nitrógeno como heteroátomo a la estructura carbonosa mediante la formación de grupos amida, lactamas, iminas y aminas (21) los cuales favorecieron la adsorción del 4-nitrofenol frente a los carbones activados G y GN. Esto debido a que el 4-nitrofenol al presentar un pKa de 7,15 a 25 °C más bajo en relación con el fenol (pKa 9,89 a 25 °C) tiene un carácter más ácido que este, debido al sustituyente nitro que es un grupo que atrae electrones y aumenta la estabilidad del ion fenóxido por deslocalización de la carga negativa (24).
Sin embargo, como se obtuvo un pH de 4,6 para la solución stock de 4-nitrofenol y entre 4,7 y 5,6 para las muestras preparadas en el equilibrio, a partir de la ecuación de Henderson-Hasselbalch se determinó que la concentración del ion 4-nitrofenóxido es 2,82 x 10-3 veces la concentración 4-nitrofenol, y por lo tanto, el reactivo se encuentra en su forma protonada. En cuanto a la superficie del carbón activado, a pH 4,6, se encuentra también protonada y la incorporación de grupos nitrogenados hace que sea mayor el grado de protonación en relación con las muestras G y GN. En estas condiciones, tanto el 4-nitrofenol como la superficie del carbón activado compiten por los protones disponibles y esto favorecería la interacción entre el carbón activado y el 4-nitrofenol por puentes de hidrógeno.
Determinación de la capacidad de adsorción
Para evaluar la adsorción de compuestos fenólicos sobre el carbón activado se han reportado estudios en los que los datos experimentales se ajustaron a los modelos de Freundlich o Langmuir. Se ha encontrado que, aunque estos son convenientes para la caracterización de los datos, tienen un potencial limitado a la predicción del comportamiento bajo condiciones dentro de los rangos de las mediciones experimentales, porque los supuestos de estos modelos no reflejan sustancialmente los procesos de adsorción (23).
El modelo Sips, mostrado en la ecuación [2], también ha sido utilizado para describir los datos de adsorción desde solución acuosa con resultados satisfactorios; en forma general, este modelo se asemeja al de Langmuir, ecuación [3], pero a diferencia de este, el modelo de Sips presenta el parámetro n. Cuando el valor de n es igual a 1, el modelo de Sips toma la forma del modelo de Langmuir.
Teniendo en cuenta que el modelo de Langmuir asume que todos los sitios de adsorción sobre la superficie del carbón activado son energéticamente equivalentes, se puede deducir que el parámetro n en el modelo de Sips está asociado a la heterogeneidad energética del sistema adsorbente-adsorbato, que puede provenir del adsorbente, del adsorbato o de una combinación de estas (11). Por lo tanto, cuando este parámetro se aproxima a 1 se puede sugerir que el sistema es energéticamente homogéneo mientras que a medida que n se aleja de 1 el sistema adsorbente-adsorbato es energéticamente heterogéneo.
Ahora bien, cuando Ce en la solución es baja, el término KSCe1/n en el modelo de Sips es pequeño y la suma de 1+ KSCe 1/n en el denominador tiende a 1. Entonces el modelo se transforma en [5]:
ecuación [5]:
La ecuación [5] presenta la misma forma del modelo de Freundlich y, en ese caso, el producto de la cantidad adsorbida en monocapa q0 por la constante de Sips KS, relacionada con la energía característica del sistema, corresponde a la constante KF de la ecuación de Freundlich.
La ecuación [6] en SigmaPlot 12 que permite calcular los parámetros del modelo de Sips se incluye en la categoría Sigmoidal, Logistic, 3 Parameter:
ecuación [6]:
que de acuerdo con la descripción de Wu et al (12), los correspondientes con el modelo de Sips son: y = qe, b = -1/n, a = qo, x0 = 1/KS, x = Ce.
Los parámetros resultantes del ajuste de los datos de adsorción de 4-nitrofenol sobre carbón activado al modelo de Sips utilizando el programa SigmaPlot, en la categoría Sigmoidal, Logistic, 3 Parameter se resumen en la Tabla 2. Con propósitos comparativos, estos mismos parámetros se calcularon utilizando el programa Statistica 7. Los datos de adsorción también se ajustaron al modelo de Langmuir utilizando el programa Statistica 7 con el fin de ver las diferencias entre los parámetros de cubrimiento y los parámetros energéticos de cada modelo. Todos estos valores también se presentan en la Tabla 2.
Tabla 2.: Tabla
2.
En la Tabla 2 se observa que los valores para los parámetros q0 y n del modelo de Sips presentan los mismos valores calculados con los programas SigmaPlot y Statistica 7, no obstante, se obtiene una diferencia significativa para el parámetro KS.
A partir del modelo de Sips se tiene que al dividir el numerador y el denominador de la ecuación entre KSCe 1/n la ecuación se transforma en [7]:
ecuación [7]:
que también puede escribirse como [8]:
ecuación [8] :
La ecuación [6] que corresponde a la fórmula Sigmoidal, Logistic, 3 Parameter de SigmaPlot también se puede escribir como [9]:
ecuación [9]:
Comparando las ecuaciones [8] y [9] se tiene que y = qe, b = -1/n, a = qo, x = Ce, de acuerdo a lo reportado en la literatura (12), pero se tiene, según la ecuación [10], lo siguiente:
ecuación [10]:
y por lo tanto, la ecuación [11]:
ecuación [11]:
Utilizando la ecuación [10] para calcular el valor de KS a partir del valor de x0 obtenido con la ecuación Sigmoidal, Logistic, 3 Parameter de SigmaPlot 12, se obtiene el valor de 8,3354 para la muestra GNA, valor que concuerda con el obtenido utilizando el programa Statistica 7.
Al dividir el numerador y el denominador del modelo de Langmuir-Freundlich ecuación [4] entre (KLFCe)1/n se obtiene [13]:
ecuación [13]:
o escrito de otra forma se obtiene [14]:
ecuación [14]:
De acuerdo como se reporta en la literatura (12) y comparando las ecuaciones [14] y [9], se observa que los parámetros qe, q0, n y Ce corresponden a y, a , -1/b y x, respectivamente. En cuanto al parámetro KLF se tiene [15]:
ecuación [15]:
Y como b = -1/n, entonces se obtiene [16]:
ecuación [16]:
Por tanto, los valores reportados por Wu et al. (12) para el ajuste de los datos utilizando el programa SigmaPlot no corresponden al modelo de Sips sino al modelo de Langmuir-Freundlich.
Otro punto a analizar es el valor de los parámetros energéticos obtenidos por cada uno de estos modelos, comparados en la Figura 5.
Figura 5: Figura
5.
En la Figura 5 se puede observar la diferencia en los valores del parámetro energético para los modelos comparados. Esto demuestra que, aunque los modelos de Sips y Langmuir- Freundlich son parecidos, difieren en este parámetro. El valor obtenido para el parámetro energético KL en el modelo de Langmuir es el más alto. Se debe tener en cuenta que este modelo matemático, al no contemplar la heterogeneidad energética del carbón activado, describe todos los sitios sobre la superficie como puntos de adsorción equivalentes. Según esto, la adsorción se llevaría a cabo de manera uniforme y, por lo tanto, la sumatoria de la energía producida en cada sitio por la adsorción daría como resultado un valor alto. Por el contrario, para la constante calculada con el modelo de Sips (KS) se obtuvo el valor más bajo que, al considerar la heterogeneidad energética de la superficie, indica que la adsorción solo se realiza sobre algunos sitios. Así, comparando el ajuste de los datos a los modelos de Langmuir y Sips mediante el valor de R, se observa que los datos presentan un mejor ajuste al modelo de Sips lo cual confirma que la superficie del carbón activado estudiado es heterogénea.
Finalmente, en la Tabla 3 se presenta el ajuste de los datos de adsorción de 4-nitrofenol al modelo de Sips utilizando el programa SigmaPlot 12 con la ecuación Sigmoidal Logistic 3 Parmeter, utilizando la ecuación [11] para el cálculo del párametro KS.
G:
Carbón activado granular Carbochem 850, GN:
Carbón activado Carbochem 850 oxidado por impregnación con ácido nítrico, GNA: carbón activado GN funcionalizado
con solución de NH4OH al 25% mediante reflujo. q0: capacidad máxima de adsorción de Sips,
KS: constante de
equilibrio de Sips, n: exponente del modelo de Sips R: coeficiente de correlaciónTabla 3.: Tabla
3.
En la Tabla 3 se puede observar que el valor para la constante KS relacionada con la energía adsorbente-adsorbato presenta el valor más alto en la adsorción sobre el carbón con mayor contenido de grupos nitrogenados en la superficie GNA y el valor más bajo en el carbón activado con mayor contenido de grupos ácidos sobre esta. Estos resultados confirman que la adsorción del compuesto fenólico se favorece con el incremento de grupos nitrogenados sobre la superficie, mientras que se desfavorece por la presencia de grupos ácidos sobre esta. En cuanto al parámetro n relacionado con la heterogeneidad del sistema, se observa que este se incrementa con el tratamiento con ácido nítrico y aún más con la presencia de grupos nitrogenados en la superficie del carbón activado.
Conclusiones
La impregnación del carbón activado con solución concentrada de ácido nítrico y posterior reflujo en hidróxido de amonio introduce nitrógeno a la estructura carbonosa como heteroátomo sobre la superficie. Los grupos nitrogenados sobre la superficie del carbón activado, favorecen la adsorción del 4-nitrofenol al incrementar la capacidad de protonación del carbón activado y por lo tanto, la formación de puentes de hidrógeno. La adsorción del 4-nitrofenol sobre el carbón activado describe una isoterma tipo H característica de fuertes interacciones adsorbente-adsorbato.
Adicionalmente, el modelo de Langmuir, al no considerar la heterogeneidad energética del sistema adsorbente-adsorbato, genera valores altos para el parámetro KL relacionado con la energía característica del sistema. Por el contrario, el modelo de Sips, debido a que contempla la heterogeneidad energética del sistema adsorbente-adsorbato, presenta un valor bajo para el parámetro energético KS.
El ajuste de los datos de adsorción a los modelos de Sips y Langmuir-Freundlich permite obtener los mismos valores para la adsorción en monocapa q0 y para el parámetro relacionado con la heterogeneidad del sistema n, mientras que se presentan diferencias en los valores obtenidos para los parámetros KS y KLF relacionados con la energía característica de los microporos.
El parámetro KS del modelo de Sips, relacionado con la energía del sistema adsorbente-adsorbato, en la ecuación Sigmoidal, Logistic, 3 Parameter del programa SigmaPlot es igual a (1/x0)-b. Sin embargo, el parámetro KLF del modelo Langmuir-Freundlich, relacionado también con la energía del sistema adsorbente-adsorbato, es igual a 1/x0 en la ecuación Sigmoidal, Logistic, 3 Parameter del programa SigmaPlot.
Agradecimientos
Los autores agradecen al convenio Marco entre la Universidad de Los Andes y la Universidad Nacional de Colombia y al acta de acuerdo establecido por los Departamentos de Química de ambas universidades.
Referencias
Referencias
Marsh, H.; Rodríguez-Reinoso, F. Porosity in Carbons: Modeling. In Activated Carbon, Elsevier Science Ltd: Oxford, 2006; pp 87-142. DOI: http://dx.doi.org/10.1016/B978-008044463-5/50018-2.
Caturla, F.; Martín-Martínez, J. M.; Molina-Sabio, M.; Rodriguez-Reinoso, F.; Torregrosa, R. Adsorption of substituted phenols on activated carbon. J. Colloid Interface Sci. 1988, 124 (2), 528-534. DOI: http://dx.doi.org/10.1016/0021-9797(88)90189-0.
Racovita, S.; Vlad, C. D.; Radu, C. D.; Vasiliu, S.; Plesca, I.; Branisteanu, D. E.; Sandu, I. C. A. Equilibrium and Kinetics Studies of 4-nitrophenol Adsorption Onto Porous Crosslinked Beads. Mater. Plast. 2016, 53 (3), 434-439. DOI: http://dx.doi.org/10.7508/gjesm.2016.01.002.
Sostenible, M. d. M. A. y. D. Resolución 0631 del 17 de marzo de 2015. 2015, 62. Disponible en: http://www.lasalle.edu.co/wps/wcm/connect/7bf35b9e-b9ac-45b3-a280-c7dec8b1499d/Resolucion+631-2015.pdf?MOD=AJPERES.
Liu, B.; Li, Y.; Gai, X.; Yang, R.; Mao, J.; Shan, S. Exceptional Adsorption of Phenol and p-Nitrophenol from Water on Carbon Materials Prepared via Hydrothermal Carbonization of Corncob Residues. BioResources 2016, 11 (3), 7566-7579. DOI: https://doi.org/10.15376/biores.11.3.7566-7579.
Álvarez-Torrellas, S.; Martin-Martinez, M.; Gomes, H.; Ovejero, G.; García, J. Enhancement of p-nitrophenol adsorption capacity through N 2-thermal-based treatment of activated carbons. Appl. Surf. Sci. 2017, 414, 424-434. DOI: https://doi.org/10.1016/j.apsusc.2017.04.054.
Dhorabe, P. T.; Lataye, D. H.; Ingole, R. S. Removal of 4-nitrophenol from aqueous solution by adsorption onto activated carbon prepared from Acacia glauca sawdust. Water Sci. Technol.2016, 73 (4), 955-966. DOI: https://doi.org/10.2166/wst.2015.575.
Matus, C.; Camú, E.; Villarroel, M.; Ojeda, J.; Baeza, P. Study of the removal of 4-nitrophenol from aqueous media by adsorption on different materials. J. Chil. Chem. Soc. 2016, 61 (1), 2832-2836. DOI: http://dx.doi.org/10.4067/S0717-97072016000100017.
Rincón-Silva, N. G.; Moreno-Piraján, J. C.; Giraldo, L. Equilibrium, kinetics and thermodynamics study of phenols adsorption onto activated carbon obtained from lignocellulosic material (Eucalyptus Globulus labill seed). Adsorption 2016, 22 (1), 33-48. DOI: https://doi.org/10.1007/s10450-015-9724-2.
Sips, R. On the Structure of a Catalyst Surface. II. J. Chem. Phys.s 1950, 18 (8), 1024-1026. DOI: http://dx.doi.org/10.1063/1.1747848.
Do, D. D., Adsorption Analysis: Equilibria and Kinetics. World Scientific: 1998; Vol. 2.
Wu, F.-C.; Wu, P.-H.; Tseng, R.-L.; Juang, R.-S. Use of refuse-derived fuel waste for the adsorption of 4-chlorophenol and dyes from aqueous solution: Equilibrium and kinetics. J. Taiwan Inst. Chem. Eng. 2014, 45 (5), 2628-2639. DOI:http://dx.doi.org/10.1016/j.jtice.2014.07.007.
Hamdaoui, O.; Naffrechoux, E. Modeling of adsorption isotherms of phenol and chlorophenols onto granular activated carbon: Part II. Models with more than two parameters. J. Hazard. Mater. 2007, 147 (1–2), 401-411. DOI: http://dx.doi.org/10.1016/j.jhazmat.2007.01.021.
Foo, K.; Hameed, B. Insights into the modeling of adsorption isotherm systems. Chem. Eng. J. 2010, 156 (1), 2-10. DOI: https://doi.org/10.1016/j.cej.2009.09.013.
Brunauer, S.; Emmett, P. H.; Teller, E. Adsorption of gases in multimolecular layers. J. Amer. Chem. Soc. 1938, 60 (2), 309-319. DOI: https://doi.org/10.1021/ja01269a023.
Dubinin, M.; Radushkevich, L. Equation of the characteristic curve of activated charcoal. Chem. Zentr. 1947, 1 (1), 875. DOI: http://dx.doi.org/10.1016/0008-6223(89)90078-X.
Vargas, D. P.; Giraldo, L.; Moreno-Piraján, J. C. CO(2) Adsorption on Activated Carbon Honeycomb-Monoliths: A Comparison of Langmuir and Tóth Models. Int. J. Mol. Sci. 2012, 13 (7), 8388-8397. DOI: http://dx.doi.org/10.3390/ijms13078388.
Thommes, M.; Kaneko, K.; Neimark, A. V.; Olivier, J. P.; Rodriguez-Reinoso, F.; Rouquerol, J.; Sing, K. S. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure Appl. Chem. 2015, 87 (9-10), 1051-1069. DOI: https://doi.org/10.1515/pac-2014-1117.
Carvajal-Bernal, A. M.; Gómez-Granados, F.; Giraldo, L.; Moreno-Piraján, J. C. Calorimetric evaluation of activated carbons modified for phenol and 2,4-dinitrophenol adsorption. Adsorption 2016, 22 (1), 13-21. DOI: https://doi.org/10.1007/s10450-015-9725-1.
Bandosz, T. J. Activated carbon surfaces in environmental remediation. Academic press: 2006; Vol. 7.
Jansen, R.; Van Bekkum, H. Amination and ammoxidation of activated carbons. Carbon 1994, 32 (8), 1507-1516. DOI: https://doi.org/10.1016/0008-6223(94)90146-5.
Giles, C. H.; MacEwan, T. H.; Nakhwa, S. N.; Smith, D. 786. Studies in adsorption. Part XI. A system of classification of solution adsorption isotherms, and its use in diagnosis of adsorption mechanisms and in measurement of specific surface areas of solids. J. Chem. Soc. (Resumed) 1960, (0), 3973-3993. DOI: https://10.1039/JR9600003973.
Dąbrowski, A.; Podkościelny, P.; Hubicki, Z.; Barczak, M. Adsorption of phenolic compounds by activated carbon—a critical review. Chemosphere 2005, 58 (8), 1049-1070. DOI: http://dx.doi.org/10.1016/j.chemosphere.2004.09.067.
Mcmurry, J. Química Orgánica. Cengage Learning Editores: México; 2001.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2018 Revista Colombiana de Química

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).

































