Evaluación de las prescripciones autorizadas entre 2010 y 2011 por vía judicial en Bogotá, D.C., Colombia
Evaluation of prescriptions authorized between 2010 and 2011 through judicial protection in Bogotá
DOI:
https://doi.org/10.15446/revfacmed.v64n4.53574Palabras clave:
Farmacoepidemiología, Interacciones de drogas, Utilización de medicamentos, Prescripciones de medicamentos, Colombia (es)Pharmacoepidemiology, Drug Interactions, Drug Utilization, Drug Prescriptions, Colombia (en)
Introducción. La tutela es una herramienta legal empleada para garantizar el derecho a la salud en Colombia.
Objetivo. Evaluar la racionalidad terapéutica de prescripciones de medicamentos autorizadas por tutela en pacientes afiliados al Sistema General de Seguridad Social en Salud.
Materiales y métodos. Estudio descriptivo con recolección retrospectiva de información de bases de datos e historias clínicas de pacientes con medicamentos ordenados por acción judicial para tres aseguradoras en Bogotá, D.C. durante los años 2010 y 2011. Se consideraron la indicación, los consumos, las dosis, la duplicidad terapéutica, el riesgo de interacciones y los costos.
Resultados. Se obtuvo información de 3 469 pacientes que solicitaron 2 419 medicamentos por tutela, siendo los más comunes antiepilépticos (10.7%), vitaminas (10%), hipoleipemiantes (5%)y antidiabéticos (4.8%). En el 75.5% de los casos el medicamento se correlacionó con el diagnóstico y el 66% de los pacientes estuvo expuesto a riesgos de interacciones farmacológicas. Se observó mayor duplicidad terapéutica en antiinflamatorios no esteroideos y antihipertensivos. El costo promedio de cada dispensación por tutela se estimó en COP 453 221 (USD 236.5).
Conclusiones. Se evidencian problemas de racionalidad terapéutica en medicamentos ordenados por tutela, lo cual puede implicar mayores riesgos para la salud de los pacientes. Es recomendable un asesoramiento científico más riguroso con la finalidad de evitar posibles riesgos de interacciones y duplicidades terapéuticas.
Introduction: Judicial protection (tutela in Spanish) is a legal tool used to ensure the right to health in Colombia.
Objective: To evaluate the therapeutic rationale of drug prescriptions authorized through judicial protection for patients enrolled in the General Social Security Health System.
Materials and methods: Descriptive study with retrospective collection of information from databases and patient records associated with medications ordered by court action against three health insurers in Bogotá, D.C., during 2010 and 2011. Prescription, consumption, doses, therapeutic duplication, risk of interactions and costs were considered.
Results: Information of 3 469 patients who requested 2 419 prescribed drugs through judicial protection was obtained; the most common drugs were anticonvulsants (10.7%), vitamins (10%), lipid-lowering medications (5%) and anti-diabetic drugs (4.8%). In 75.5% of cases the drug was correlated with the diagnosis and 66% of patients were exposed to drug interaction risks. Greater therapeutic duplication was observed in non-steroidal anti-inflammatory and antihypertensive drugs. The average cost of each dispensation per judicial protection issued was estimated at COP 453 221 (USD 236.5).
Conclusions: Therapeutic rationality issues are evident in prescription drugs ordered by judicial protection, which may involve greater risks to the health of patients. A more rigorous scientific advice is recommended in order to avoid possible interactions and therapeutic duplications.investigación original
DOI: https://doi.org/10.15446/revfacmed.v64n4.53574
Evaluación de las prescripciones autorizadas entre 2010
y 2011 por vía judicial en Bogotá, D.C., Colombia
Evaluation of prescriptions authorized between 2010 and 2011 through judicial protection in Bogotá
Recibido: 01/10/2015. Aceptado: 15/12/2015.
Alfredo Portilla-Pinzón1 • José Julián López1 • Mauricio Montoya-Cañon2 • Jorge Enrique Machado-Alba2
1 Universidad Nacional de Colombia - Sede Bogotá - Facultad de Ciencias - Departamento de Farmacia - Grupo RAM: Red para el uso adecuado de medicamentos - Bogotá, D.C. - Colombia.
2 Universidad Tecnológica de Pereira-Audifarma S.A. - Grupo de Investigación en Farmacoepidemiología y Farmacovigilancia - Pereira - Colombia.
Correspondencia: Jorge Enrique Machado-Alba. Grupo de Investigación en Farmacoepidemiología y Farmacovigilancia, Universidad Tecnológica de Pereira. Carrera 27 No. 10-02. Teléfono: +57 6 3137800. Pereira. Colombia. Correo electrónico: machado@utp.edu.co.
| Resumen |
Introducción. La tutela es una herramienta legal empleada para garantizar el derecho a la salud en Colombia.
Objetivo. Evaluar la racionalidad terapéutica de prescripciones de medicamentos autorizadas por tutela en pacientes afiliados al Sistema General de Seguridad Social en Salud.
Materiales y métodos. Estudio descriptivo con recolección retrospectiva de información de bases de datos e historias clínicas de pacientes con medicamentos ordenados por acción judicial para tres aseguradoras en Bogotá, D.C. durante los años 2010 y 2011. Se consideraron la indicación, los consumos, las dosis, la duplicidad terapéutica, el riesgo de interacciones y los costos.
Resultados. Se obtuvo información de 3 469 pacientes que solicitaron 2 419 medicamentos por tutela, siendo los más comunes antiepilépticos (10.7%), vitaminas (10%), hipoleipemiantes (5%)y antidiabéticos (4.8%). En el 75.5% de los casos el medicamento se correlacionó con el diagnóstico y el 66% de los pacientes estuvo expuesto a riesgos de interacciones farmacológicas. Se observó mayor duplicidad terapéutica en antiinflamatorios no esteroideos y antihipertensivos. El costo promedio de cada dispensación por tutela se estimó en COP 453 221 (USD 236.5).
Conclusiones. Se evidencian problemas de racionalidad terapéutica en medicamentos ordenados por tutela, lo cual puede implicar mayores riesgos para la salud de los pacientes. Es recomendable un asesoramiento científico más riguroso con la finalidad de evitar posibles riesgos de interacciones y duplicidades terapéuticas.
Palabras clave: Farmacoepidemiología; Interacciones de drogas; Utilización de medicamentos; Prescripciones de medicamentos; Colombia (DeCS).
Portilla-Pinzón A, López JJ, Montoya-Cañon M, Machado-Alba JE. Evaluación de las prescripciones autorizadas entre 2010 y 2011 por vía judicial en Bogotá, D.C., Colombia. Rev. Fac. Med. 2016;64(4):679-86. Spanish. doi: https://doi.org/10.15446/revfacmed.v64n4.53574.
| Abstract |
Introduction: Judicial protection (tutela in Spanish) is a legal tool used to ensure the right to health in Colombia.
Objective: To evaluate the therapeutic rationale of drug prescriptions authorized through judicial protection for patients enrolled in the General Social Security Health System.
Materials and methods: Descriptive study with retrospective collection of information from databases and patient records associated with medications ordered by court action against three health insurers in Bogotá, D.C., during 2010 and 2011. Prescription, consumption, doses, therapeutic duplication, risk of interactions and costs were considered.
Results: Information of 3 469 patients who requested 2 419 prescribed drugs through judicial protection was obtained; the most common drugs were anticonvulsants (10.7%), vitamins (10%), lipid-lowering medications (5%) and anti-diabetic drugs (4.8%). In 75.5% of cases the drug was correlated with the diagnosis and 66% of patients were exposed to drug interaction risks. Greater therapeutic duplication was observed in non-steroidal anti-inflammatory and antihypertensive drugs. The average cost of each dispensation per judicial protection issued was estimated at COP 453 221 (USD 236.5).
Conclusions: Therapeutic rationality issues are evident in prescription drugs ordered by judicial protection, which may involve greater risks to the health of patients. A more rigorous scientific advice is recommended in order to avoid possible interactions and therapeutic duplications.
Keywords: Pharmacoepidemiology; Drug Interactions; Drug Utilization; Drug Prescriptions; Colombia (MeSH).
Portilla-Pinzón A, López JJ, Montoya-Cañon M, Machado-Alba JE. [Evaluation of prescriptions authorized between 2010 and 2011 through judicial protection in Bogotá]. Rev. Fac. Med. 2016;64(4):679-86. Spanish. doi: https://doi.org/10.15446/revfacmed.v64n4.53574.
Introducción
La tutela es un mecanismo jurídico por el cual los ciudadanos colombianos pueden defender sus derechos fundamentales cuando estos se encuentran amenazados. Aunque los derechos se encuentran consagrados en la constitución política del país (1), se han observado situaciones en las cuales la tutela se ha visto implicada en un uso inadecuado de medicamentos (2).
La Organización Mundial de la Salud (OMS) define al uso racional de medicamentos como el empleo correcto y apropiado de los mismos, prescritos al paciente correcto de acuerdo a sus necesidades clínicas, a la dosis debida y durante un tiempo suficiente para lograr el objetivo terapéutico con el menor costo posible tanto para él como para la sociedad (3).
La Política Farmacéutica Nacional del año 2012 afirma que parte de los problemas sobre fármacos en Colombia tienen entre sus principales causas un uso irracional e inadecuado de los medicamentos y una deficiente calidad de la atención. Dicha situación depende de aspectos relacionados con prácticas inadecuadas de uso, debilidades del recurso humano, vigilancia insuficiente de la publicidad y de la promoción farmacéutica y, por último, la dispersión y falta de integralidad en la prestación de los servicios farmacéuticos (4).
Según el informe Tutela y Derecho a la Salud 2010 de la Defensoría del Pueblo, en el 2010 se registró el mayor número de tutelas presentadas por los colombianos en los últimos 12 años, acercándose a las 100 000. No obstante, este incremento no implica que, de manera directa, se estén violando más derechos, sino que la sociedad es cada vez más consciente y está más informada (5). Para este mismo año, el 9.9% de las tutelas que invocaban el derecho a la protección social o la salud fueron entabladas en Bogotá, D.C., lo que ubicó a esta ciudad en el tercer lugar de clasificación de regiones del país con mayor número de tutelas después de Antioquia (26.0%) y Valle (10.7%). Por otra parte, y como principal argumento para la justificación del presente trabajo, en el 2010 el 24.2% de las tutelas estuvieron relacionadas con fármacos, de las cuales 34.9% fueron por medicamentos incluidos en el plan obligatorio de salud (POS) (1,6).
El objetivo del presente estudio fue evaluar la racionalidad terapéutica de las prescripciones de medicamentos autorizadas por tutela durante los años 2010 y 2011 en tres entidades promotoras de salud (EPS) de Bogotá, D.C.
Materiales y métodos
Estudio de corte transversal que toma la información contenida en las bases de datos de dispensación de Audifarma S.A., principal operador logístico de dispensación de medicamentos en Colombia, para tres EPS del régimen contributivo en Bogotá, D.C. durante los años 2010 y 2011. El presente corresponde a un estudio farmacoepidemiológico de utilización de medicamentos de tipo prescripción-indicación, con elementos de consumo involucrando cuáles medicamentos se dispensaron por acción de tutela y en qué cantidades (7).
La recolección de la información involucró, en primer lugar, la identificación de los medicamentos —sus consumos y sus costos— solicitados a través de tutela por parte de toda la población afiliada a tres entidades asociadas al Sistema General de Seguridad Social en Salud de Colombia (SGSSS). Luego, se realizó el análisis de la información mediante la evaluación de la racionalidad terapéutica, se procedió al establecimiento de relaciones entre las bases de dispensación de medicamentos (aportada por Audifarma S.A.) y la historia clínica (aportada por las EPS incluidas en el estudio) y se establecieron cinco categorías para establecer la racionalidad:
Pertinencia de uso: se exploró la relación entre los medicamentos dispensados por orden de tutela y los diagnósticos médicos presentes en la historia clínica. Se procedió a comparar las indicaciones aprobadas por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) y la Food and Drug Administration (FDA) para los medicamentos que componían la farmacoterapia dispensada por tutela en los pacientes de la muestra contra los diagnósticos establecidos en la historia clínica desde el 2005, año en el que se iniciaron los primeros procesos de tutela que terminaron en dispensación de medicamentos en el tiempo de estudio hasta el año 2012 (8).
Dosificación: utilizando la dosis diaria definida (DDD) promedio por paciente, se realizó una aproximación a la dosis media utilizada para los medicamentos más consumidos por orden de tutela. Para realizar esta medición se obtuvo el cociente de la razón entre el número de DDD consumidas y el número de pacientes que las utilizaron (9).
Riesgo de interacciones farmacológicas: utilizando la herramienta ofrecida por Thomson Micromedex®, se realizó la búsqueda de interacciones farmacológicas con relevancia clínica contraindicada, mayor y moderada. Para el desarrollo de esta tarea, fue necesaria la realización de búsquedas individuales en cada uno de los pacientes pertenecientes a la muestra; el análisis se realizó contrastando los medicamentos dispensados por acción de tutela y el resto de la terapia de cada paciente. El tiempo de exposición a las combinaciones de fármacos que generan riesgo se obtuvo a partir del historial de medicamentos de cada uno de los pacientes y se midió teniendo en cuenta por lo menos una única dispensación concomitante en 24 meses (10).
Duplicidad terapéutica: mediante asignación aleatoria se seleccionaron los siguientes grupos farmacológicos según la clasificación ATC (Anatomical Therapeutic Chemical), sobre estos se realizó búsqueda de duplicidades terapéuticas: agentes modificadores de los lípidos, medicamentos usados en diabetes, agentes antitrombóticos, agentes betabloqueantes, agentes que actúan sobre el eje renina angiotensina aldosterona, productos antiinflamatorios y antirreumáticos, medicamentos para desórdenes funcionales gastrointestinales, preparados de uso nasal y antihistamínicos (11).
Uso previo de alternativas existentes en el POS: mediante la historia farmacológica (historia de dispensación de medicamentos) se estudió si el uso de los medicamentos dispensados por orden de tutela tenía como antecedente el uso de alternativas terapéuticas incluidas dentro del POS. Este ejercicio se realizó solo en aquellos medicamentos que contaban con opciones de tratamientos dentro del mencionado plan (12).
Los costos fueron estimados como el producto del consumo de los medicamentos de la subcuenta tutela (unidades) multiplicado por el costo de compra de los medicamentos a partir de una lista de precios de referencia del año 2011.
La población incluyó los 3 469 sujetos pertenecientes a tres EPS de Bogotá, D.C. con dispensaciones realizadas en los años 2010 y 2011 y registradas en la subcuenta tutela. Para definir de manera específica las relaciones del diagnóstico clínico en los pacientes con la terapia ordenada, la dosis, las interacciones, las duplicidades y el uso de alternativas POS —racionalidad terapéutica— se seleccionó una muestra aleatoria de 100 pacientes (frecuencia esperada del evento: 50%; límites de confianza: 10%); para la estimación de la muestra se utilizó el programa Epiinfo 7 y a través de una tabla de números aleatorios en Microsoft Excel se realizó la aleatorización.
Se tomaron variables demográficas como edad, sexo, afiliación al SGSSS y EPS; se ingresaron datos del diagnóstico principal motivo de la tutela, las comorbilidades, la denominación común internacional de los medicamentos dispensados por este mecanismo y otros fármacos que estuviese consumiendo el paciente; se evaluó si existían y si habían sido utilizadas con anterioridad alternativas terapéuticas existentes dentro del POS colombiano y posibles interacciones farmacológicas reportadas, si existía duplicidad terapéutica y si en las prescripciones se podían identificar contraindicaciones en los medicamentos dependiendo de las características de cada paciente.
Las variables cualitativas fueron resumidas con frecuencias absolutas y porcentajes, mientras que las variables cuantitativas continuas se describieron a partir de medidas de tendencia central de dispersión. Los datos se ingresaron en una base de datos en Microsoft Excel y los análisis estadísticos en el programa IBM SPSS 14.0 para Windows.
El trabajo fue clasificado como una investigación sin riesgo según la Resolución 8430 del 1993 del Ministerio de Salud considerando los principios bioéticos de investigación trazados por la Declaración de Helsinki.
Resultados
Se obtuvo información total de dispensación de medicamentos perteneciente a 3 469 pacientes del régimen contributivo afiliados a tres EPS durante un periodo de dos años (2010-2011); 57% de estos eran mujeres, la edad mediana fue 46.5 años (rango intercuartílico: 3-83 años) con un valor promedio de tres diagnósticos o morbilidades por paciente. Esta población solicitó por tutela 2 419 medicamentos, correspondientes a 413 principios activos diferentes que fueron entregados en 159 625 dispensaciones y registrados en la subcuenta del mismo nombre. Se hicieron cerca de 46 dispensaciones por paciente en los dos años (2 dispensaciones/mes).
Los medicamentos de mayor dispensación se encuentran relacionados en la Tabla 1; ya que esta contiene el grupo, conformado en su totalidad por 413 principios activos ubicados en el percentil 80 de los medicamentos que cuentan con una DDD publicada por la OMS, es posible presentarlos en número de DDD por 100 000 afiliados y día (D.H.D) (Figura 1).
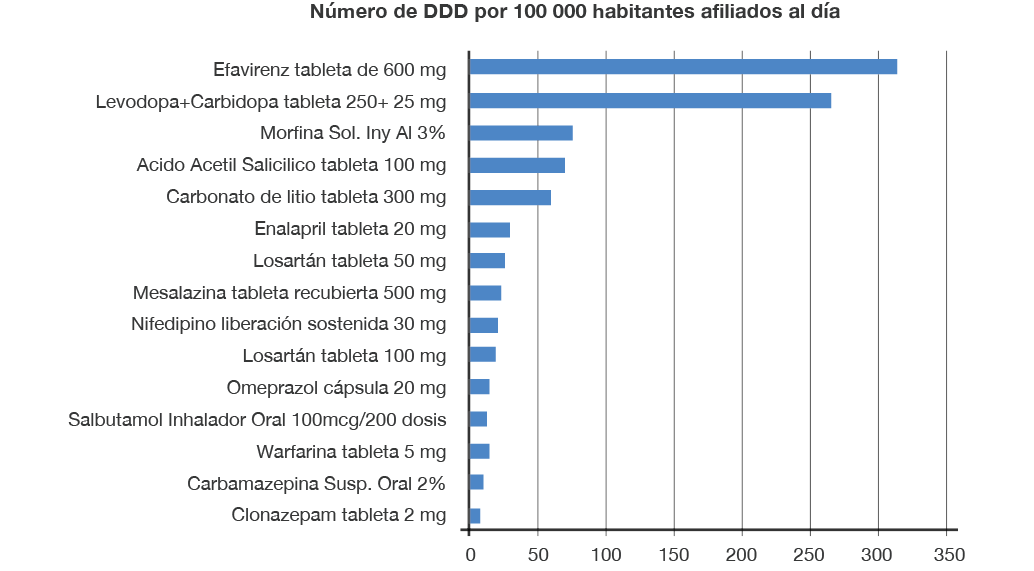
Figura 1. Distribución de los medicamentos incluidos en el Plan Obligatorio de Salud de mayor dispensación por tutela según dosis diaria definida. DDD: Dosis diaria definida. Fuente: Elaboración propia.
Pertinencia de uso de medicamentos
Sobre el percentil 80 de los medicamentos más prescritos se hallaron 45 principios activos en los que se pudo establecer una relación entre la dispensación (considerada como la indicación de uso) y el diagnóstico establecido en la historia clínica en 105 de 139 dispensaciones, correspondiente a los 100 pacientes de la muestra, lo que implicó que en el 75.5% de los casos hubo correlación y pertinencia entre lo formulado y el problema de salud a tratar.
Dosificación
En la Tabla 2 se muestra el número de pacientes de la muestra que recibían los medicamentos de manera más frecuente prescritos por tutela con el promedio de DDD y el tiempo promedio de uso de los mismos.
Tabla 1. Medicamentos según clasificación anatómico-terapéutica con mayor número de dispensaciones por tutela en tres EPS de Bogotá, D.C. 2010-2011.
|
Grupo anatómico y subgrupo terapéutico |
Número de dispensaciones |
% Dispensaciones dentro de subgrupo |
|
|
Tracto alimentario y metabolismo |
Vitaminas |
14 840 |
10% |
|
Medicamentos usados en diabetes |
7 114 |
4.80% |
|
|
Agentes para tratamientos de alteraciones causadas por ácidos |
3 550 |
2.40% |
|
|
Suplementos minerales |
1 830 |
1.20% |
|
|
Drogas para los desórdenes funcionales gastrointestinales |
1 502 |
1% |
|
|
Laxantes |
1 224 |
0.80% |
|
|
Preparados contra la obesidad, excluye productos dietéticos |
616 |
0.40% |
|
|
Terapia biliar y hepática |
609 |
0.40% |
|
|
Antidiarreicos, agentes antiiflamatorios/antiinfecciosos |
509 |
0.30% |
|
|
Digestivos, incluye enzimas |
307 |
0.20% |
|
|
Preparados estomatológicos |
263 |
0.20% |
|
|
Otros productos para el tracto alimentario y metabolismo |
52 |
0.00% |
|
|
Antieméticos |
34 |
0.00% |
|
|
Subtotal |
32 544 |
22% |
|
|
Sistema nervioso |
Antiepilépticos |
15 835 |
10.70% |
|
Psicolépticos |
4 992 |
3.40% |
|
|
Psicoanalépticos |
3 950 |
2.70% |
|
|
Analgésicos |
3 554 |
2.40% |
|
|
Antiparkinsonianos |
923 |
0.40% |
|
|
Otros medicamentos que actúan en el sistema nervioso |
411 |
0.30% |
|
|
Anestésicos |
277 |
0.20% |
|
|
Agentes anabólicos para uso sistémico |
4 |
0.00% |
|
|
Subtotal |
29 942 |
20% |
|
|
Sistema cardiovascular |
Agentes modificadores de lípidos |
7 455 |
5.00% |
|
Agentes beta-bloqueantes |
3 889 |
2.60% |
|
|
Agentes que actúan sobre el sistema renina-angiotensina |
3 547 |
2.40% |
|
|
Bloqueantes de canales de calcio |
1 782 |
1.20% |
|
|
Terapia cardiaca |
1 716 |
1.20% |
|
|
Vasopresores |
1 447 |
1.00% |
|
|
Antihipertensivos |
482 |
0.30% |
|
|
Diuréticos |
294 |
0.20% |
|
|
Vasodilatadores periféricos |
145 |
0.10% |
|
|
Subtotal |
20 757 |
14% |
|
|
Total |
83 153 |
56% |
|
Fuente: Elaboración propia.
Tabla 2. Dosis diaria definida promedio y duración de tratamientos dispensados por tutela en Bogotá, D.C. 2010-2011.
|
Medicamentos |
Pacientes con dispensación (n=100) |
Número de DDD por paciente |
Tiempo de tratamiento (promedio meses) |
|
Losartan |
16 |
2.4 |
39.5 |
|
Atorvastatina |
7 |
1.9 |
27.0 |
|
Pregabalina |
6 |
1.7 |
20.7 |
|
Somatropina |
5 |
2.0 |
32.2 |
|
Esomeprazol |
5 |
1.6 |
22.0 |
|
Infliximab |
4 |
2.1 |
10.3 |
|
Carvedilol |
4 |
1.5 |
32.8 |
|
Sildenafil |
3 |
1.8 |
16.3 |
DDD: dosis diaria definida. Fuente: Elaboración propia.
Riesgo de interacciones farmacológicas
En 66 de los 100 pacientes de la muestra se identificaron, en por lo menos una sola dispensación, riesgos de interacciones farmacológicas; fueron evidentes 526 combinaciones de medicamentos que tienen reportado algún riesgo en la literatura (ocho interacciones en promedio por paciente). El tiempo de exposición a la interacción osciló entre 1 a 23 meses (4.7±3.4 meses).
De las 526 combinaciones de medicamentos, 44 (8.3%) presentaban interacciones con riesgos menores, 320 (60.8%) con riesgos moderados, 157 (29.8%) con riesgos mayores y 5 (1%) se encontraban contraindicadas según la literatura (inhibidores selectivos de recaptación de serotonina con metoclopramida, ezetimiba+/simvastatina con gemfibrozilo, ciprofloxacina con tizanidina y salmeterol con fluconazol).
Duplicidad terapéutica
En la Tabla 3 puede observarse la discriminación de los pacientes de la muestra con su historial de medicamentos durante el año 2010 y la cantidad de ellos que tuvieron duplicidad en alguno de los subgrupos terapéuticos evaluados.
Uso de alternativas previas incluidas en el POS
El 60% de los pacientes que estaban recibiendo medicamentos por prescripción mediada por una tutela tenían evidencia en su historia clínica de haber estado recibiendo alternativas farmacológicas incluidas en el POS (Tabla 4).
Tabla 3. Duplicidad terapéutica en pacientes con dispensación de medicamentos por tutela en Bogotá, D.C. 2010-2011.
|
Subgrupo terapéutico (clasificación ATC) |
Duplicidad evaluada |
Número de pacientes en tratamiento con subgrupo |
Número de pacientes con duplicidad |
% |
|
Productos antiinflamatorios y antirreumáticos |
AINE |
59 |
22 |
37.3 |
|
Agentes contra padecimientos del estómago |
Inhibidor de bomba de protones |
64 |
18 |
28.1 |
|
Agentes que actúan sobre el sistema angiotensina |
Antagonistas receptores de angiotensina II |
27 |
8 |
29.6 |
|
Antihistamínicos para uso sistémico |
Antihistamínicos |
51 |
7 |
13.7 |
|
Agentes beta-bloqueantes |
Beta-bloqueadores |
21 |
6 |
28.6 |
|
Agentes modificadores de lípidos |
Estatinas |
30 |
4 |
13.3 |
|
Medicamentos usados en diabetes |
Insulina |
12 |
2 |
16.7 |
|
Agentes antitrombóticos |
Heparinas de bajo peso molecular |
16 |
2 |
12.5 |
|
Preparados de uso nasal |
Corticoides |
25 |
2 |
8.0 |
ATC: Anatomical Therapeutic Chemical. Fuente: Elaboración propia.
Resultados de costos
El 40% del costo de los medicamentos dispensados por tutela al total de pacientes estudiados fue generado solo por dos grupos de medicamentos, los inmunosupresores (28%) y aquellos para el sistema nervioso central (12%), en especial los antiepilépticos (7%). Otros grupos de importancia fueron las hormonas hipofisiarias e hipotálamicas y sus análogos (7%), los antihemorrágicos (6%) y los inmunoestimulantes (5%).
El costo global medio por cada dispensación por tutela se estimó en COP 453 221 (USD 236.5) y por paciente en el tiempo de estudio en COP 6 345 496 (USD 3 311.4); no obstante, estos valores medios muestran una amplia variación entre grupos anatómicos, siendo más elevado en antineoplásicos e inmunomoduladores —costo medio por dispensación: COP 1 952 071 (USD 1 018.7); costo medio por paciente: COP 23 966 804 (USD 125 073)— y en preparados hormonales sistémicos —costo medio por dispensación: COP 1 151 363 (USD 600.8); costo medio por paciente: COP 10 711 792 (USD 5 590.0)— (tasa representativa del mercado de COP 1942.72 por dólar al 31 de diciembre del 2011 según página web del Banco de la República). Respecto a los medicamentos POS que se dispensaron por orden de tutela, se puede decir que el 97% del costo de estos se encontraba distribuido en presentaciones comerciales para las cuales se facturaron COP 363 521 431 (USD 187 119) en 2010 y COP 373 353 787 (USD 192 180) en 2011 contra denominaciones genéricas (3%; promedio para los dos años de COP $10 533 000 (USD 5 421)).
Tabla 4. Frecuencia de uso de medicamentos que habían sido dispensados a pacientes y que luego fueron solicitados por tutela en Bogotá, D.C. 2010-2011.
|
Medicamentos |
Pacientes con dispensación |
Evidencia de uso de alternativas POS |
|
|
Sí |
No |
||
|
Losartan |
16 |
15 |
1 |
|
Atorvastatina |
7 |
2 |
5 |
|
Pregabalina |
6 |
1 |
5 |
|
Esomeprazol |
5 |
3 |
2 |
|
Insulinas análogas |
5 |
2 |
3 |
|
Oxcarbazepina |
5 |
1 |
4 |
|
Infliximab |
4 |
4 |
0 |
|
Baclofeno |
4 |
2 |
2 |
|
Carvedilol |
4 |
1 |
3 |
|
Fumarato de momentasona |
4 |
1 |
3 |
|
Levetiracetam |
3 |
3 |
3 |
|
Etanercept |
3 |
3 |
0 |
|
Vigabatrin |
3 |
2 |
1 |
|
Ezetimiba con o sin estatina |
3 |
1 |
2 |
|
Ácido Acetil Salicílico |
3 |
1 |
2 |
|
Otros |
23 |
8 |
15 |
POS: Plan Obligatorio de Salud. Fuente: Elaboración propia.
Discusión
Utilizando como marco de referencia la dispensación, se evidencian y se pueden evaluar problemas de racionalidad terapéutica en medicamentos ordenados por una acción de tutela acorde a lo planteado en esta investigación. En algunos aspectos de los observados en este trabajo, el fallo de tutela se presenta más como un riesgo que contradice su filosofía inicial, es decir, la protección de los derechos fundamentales de la población, en este caso, el derecho a la salud y a la vida. De acuerdo a los hallazgos, se puede identificar que las decisiones tomadas por vía judicial podrían no contribuir necesariamente al uso racional de medicamentos, pues algunas de las observaciones sugieren un uso no adecuado del recurso (2).
Los medicamentos de mayor dispensación por orden de tutela corresponden a aquellos utilizados en el tratamiento de enfermedades de alta prevalencia como hipertensión arterial, diabetes mellitus y dislipidemias o de alto costo tales como antiepilépticos, psicolépticos y psicoanalépticos. Para el abordaje farmacológico de estas patologías, el SGSSS ha establecido un plan obligatorio que cubre de manera integral el tratamiento de los mismos. Sin embargo, algunos de los medicamentos que se solicitaron por acción de tutela se encontraban incluidos dentro de este plan; la solicitud por tutela de medicamentos incluidos en el POS, al parecer, está relacionada con marcas comerciales específicas. Estas solicitudes no tienen razón de ser si se tiene en cuenta que los medicamentos comercializados en Colombia cuentan con criterios de calidad farmacopéicos. Por otra parte, la forma para determinar que un medicamento en denominación comercial es más efectivo o seguro que un producto genérico es bastante compleja, la mayor aproximación puede hacerse a través de estudios de bioequivalencia y equivalencia terapéutica, pero son pocas las investigaciones de este tipo en el país; no obstante, hay evidencias publicadas de que no existe diferencia entre ellos (13-16).
Otros estudios han mostrado la frecuencia con que se presentan interacciones en pacientes ambulatorios con resultados similares (72% vs. 66% en este trabajo), pero además en este caso se pudo establecer que la tercera parte de los sujetos de la muestra estuvo expuesta por lo menos a un riesgo de interacción farmacológica con relevancia clínica, lo cual eleva el riesgo de eventos adversos (17).
En el 40% de los casos se dispensan medicamentos por orden de tutela a pacientes en cuyo historial de medicamentos no se evidencia el uso previo de alternativas incluidas dentro del POS. En aquellos casos en los que se cuenta con opciones incluidas dentro del manual de medicamentos —las cuales pueden tener igual o mayor efectividad respecto a las nuevas alternativas—, el uso de “presentaciones con valores agregados”, tales como formas farmacéuticas novedosas, medicamentos con nuevos mecanismos de acción o con avances farmacocinéticos y biofarmacéuticos que repercuten en la ampliación de los márgenes de seguridad del medicamento, podría ser una explicación plausible para su uso sin agotar los recursos incluidos en el plan de beneficios (18-21).
Además de la reconciliación entre las cuestiones jurídicas y clínicas, es necesario que dentro del análisis del uso de medicamentos ordenados por tutela se incluyan, como argumentación que justifica el fallo, algunos aspectos del contexto social muy importantes. Visto de esta manera, un paciente puede recibir la dispensación de un mismo principio activo dos o más veces en el mismo mes mientras que solicita paralelamente homólogos por tutela (22,23).
Los recursos en gestión de la información continúan siendo insuficientes, lo cual facilita la duplicidad de prescripciones. Si al final una tutela falla a favor de un medicamento determinado, es muy seguro que ninguno de los anteriores profesionales se entere, a no ser que uno de ellos haya prescrito ese medicamento, y por lo tanto siga prescribiéndolo.
Entre las limitaciones del estudio se encontró que solo se tomaron datos de tres aseguradores de régimen contributivo de una sola ciudad del país, lo que hace que los resultados sean aplicables a poblaciones con similares características sociodemográficas y de aseguramiento. El tomar una muestra permitió ampliar la información disponible sobre la racionalidad de la tutela, pero esto puede implicar que muchas otras situaciones no hayan sido incluidas en este trabajo.
Conclusión
Se puede concluir que sin un conocimiento previo de la historia clínica o farmacológica detallada y un asesoramiento científico o especializado, el fallo de tutela puede incluir en la farmacoterapia riesgos adicionales como dispensación de medicamentos sin indicación aparente o con indicaciones no aprobadas por la autoridad competente; interacciones farmacológicas con potenciales riesgos, muchas de ellas de relevancia clínica mayor; duplicidades terapéuticas que incrementan los riesgos de reacciones adversas, e incrementos innecesarios de costos (3,11).
Es recomendable entonces que la prescripción de medicamentos por tutela tenga un asesoramiento científico más riguroso con el fin de evitar posibles riesgos para los pacientes que reciben prescripciones por este mecanismo, así como duplicidades terapéuticas.
Conflictos de interés
Ninguno declarado por los autores.
Financiación
Ninguna declarada por los autores.
Agradecimientos
A la Universidad Nacional de Colombia y a la Universidad Tecnológica de Pereira.
Referencias
1. Colombia. Asamblea Nacional Constituyente. Constitución Política de Colombia de 1991. Bogotá, D.C.: Gaceta Constitucional 116; julio 20 de 1991 [cited 2014 Mar 1]. Available from: http://goo.gl/itoCWo.
2. Defensoría del Pueblo. La tutela y derecho a la Salud 2012. Bogotá, D.C.: Defensoría del Pueblo; 2013 [cited 2014 Mar 1]. Available from: https://goo.gl/69Dqq1.
3. Organización Mundial de la Salud. Promoción del uso racional de medicamentos: componentes centrales. Ginebra: Perspectivas Políticas de la OMS sobre Medicamentos No. 5; 2002 [cited 2014 Mar 1]. Available from: https://goo.gl/jakja8.
4. Consejo Nacional de Política Económica y Social, Departamento Nacional de Planeación. Documento Conpes Social: Política Farmacéutica Nacional. Bogotá, D.C.: MinSalud; 2012 [cited 2014 Mar 1]. Available from: https://goo.gl/hppI58.
5. Defensoría del Pueblo. La tutela y derecho a la Salud 2010. Bogotá, D.C.: Defensoría del Pueblo; 2011 [cited 2014 Mar 1]. Available from: https://goo.gl/LUdCpx.
6. Colombia. Corte Constitucional. Sentencia T-760 de 2008 (julio 31). M.P. Manuel José Cepeda Espinosa [cited 2014 Mar 1]. Available from: https://goo.gl/YBLcqL.
7. Álvarez-Luna F. Farmacoepidemiología. Estudios de Utilización de Medicamentos. Parte I: Concepto y metodología. Seguim Farmacoter. 2004;2(3):129-36.
8. Drug Approvals and Databases. Silver Spring: U.S. Food and Drug Administration (FDA). [cited 2014 Mar 1]. Available from: https://goo.gl/1RqiJX.
9. Definition and general considerations. Olso: World Health Organization Collaboration Centre for Drug Statistics Methodology. [cited 2014 Mar 1]. Available from: https://goo.gl/qv4t0z.
10. Micromedex® Solutions. Web application access. Truven Health Analytics Inc. [cited 2014 May 1]. Available from: https://goo.gl/vUGIOL.
11. WHO Collaboration Centre for Drug Statistics Methodology. ATC/DDD Index 2014. Oslo: WHO; 2014 [cited 2014 Mar 1]. Available from: https://goo.gl/dk5qY7.
12. Colombia. Comisión de Regulación en Salud. Acuerdo 29 de 2011 (diciembre 28): Por el cual se sustituye el Acuerdo 28 de 2011 que define, aclara y actualiza integralmente el Plan Obligatorio de Salud. Bogotá, D.C.: Diario Oficial 48298; diciembre 30 de 2011 [cited 2013 Mar]. Available from: https://goo.gl/wm3SDy.
13. Vacca-González CP, Fitzgerald JF, Bermúdez JAZ. Definición de medicamento genérico ¿un fin o un medio? Análisis de la regulación en 14 países de la Región de las Américas. Rev. Panam. Salud Publica. 2006;20(5):314-23. http://doi.org/dvjm8x.
14. Cullen W, Murray P, Harnett A. Generic statins: effectiveness, affordability, and patient adherence. Ann. Intern. Med. 2014;161(6):447-8. http://doi.org/bsjw.
15. Kaplan WA, Ritz LS, Vitello M, Wirtz VJ. Policies to promote use of generic medicines in low and middle income countries: a review of published literature, 2000-2010. Health Policy. 2012;106(3):211-24. http://doi.org/bsjx.
16. Kohli E, Buller A. Factors influencing consumer purchasing patterns of generic versus brand name over-the-counter drugs. South Med. J. 2013;106(2):155-60. http://doi.org/bsjz.
17. Morgan NA, Rowett D, Currow DC. Analysis of drug interactions at the end of life. BMJ Support Palliat. Care. 2015;5(3):281-6. http://doi.org/bsj2.
18. Gutiérrez F, Amariles P, Galindo J, Mueses H, Agudelo J, Hincapié J. Efectividad y seguridad del esquema genérico lamivudina/zidovudina/efavirenz en pacientes VIH (+). Estudio fase IV y comparación con el mismo esquema de medicamentos innovadores. Vitae. 2013;20(1):30-40.
19. Medina AP, Olaya FJ, Navas MP, Tilano AM, Muñoz E. Estudio de bioequivalencia de montelukast en tabletas masticables de 5 mg. Biomedica. 2012;32(3):399-407. http://doi.org/bsj4.
20. Colombo GL, Agabiti-Rosei E, Margonato A, Mencacci C, Montecucco CM, Trevisan R. Off-patent generic medicines vs. off-patent brand medicines for six reference drugs: a retrospective claims data study from five local healthcare units in the Lombardy Region of Italy. PLoS One. 2013;8(12):e82990. http://doi.org/bsj5.
21. Keenum AJ, Devoe JE, Chisolm DJ, Wallace LS. Generic medications for you, but brand-name medications for me. Res. Social Adm. Pharm. 2012;8(6):574-8. http://doi.org/bsj6.
22. García AM. State laws regulating prescribing of controlled substances: balancing the public health problems of chronic pain and prescription painkiller abuse and overdose. J. Law Med. Ethics. 2013;41(Suppl 1):42-5. http://doi.org/bsj7.
23. Yahalom Z, Shani S. [Prescribing information for drugs--legal and regulatory implications]. Harefuah. 2014;153(11):671-4.
César Alexander Eslava Franco
“Mapas anatómicos”
Universidad Nacional de Colombia
Referencias
Colombia. Asamblea Nacional Constituyente. Constitución Política de Colombia de 1991. Bogotá, D.C.: Gaceta Constitucional 116; julio 20 de 1991 [cited 2014 Mar 1]. Available from: http://goo.gl/itoCWo.
Defensoría del Pueblo. La tutela y derecho a la Salud 2012. Bogotá, D.C.: Defensoría del Pueblo; 2013 [cited 2014 Mar 1]. Available from: https://goo.gl/69Dqq1.
Organización Mundial de la Salud. Promoción del uso racional de medicamentos: componentes centrales. Ginebra: Perspectivas Políticas de la OMS sobre Medicamentos No. 5; 2002 [cited 2014 Mar 1]. Available from: https://goo.gl/jakja8.
Consejo Nacional de Política Económica y Social, Departamento Nacional de Planeación. Documento Conpes Social: Política Farmacéutica Nacional. Bogotá, D.C.: MinSalud; 2012 [cited 2014 Mar 1]. Available from: https://goo.gl/hppI58.
Defensoría del Pueblo. La tutela y derecho a la Salud 2010. Bogotá, D.C.: Defensoría del Pueblo; 2011 [cited 2014 Mar 1]. Available from: https://goo.gl/LUdCpx.
Colombia. Corte Constitucional. Sentencia T-760 de 2008 (julio 31). M.P. Manuel José Cepeda Espinosa [cited 2014 Mar 1]. Available from: https://goo.gl/YBLcqL.
Álvarez-Luna F. Farmacoepidemiología. Estudios de Utilización de Medicamentos. Parte I: Concepto y metodología. Seguim Farmacoter. 2004;2(3):129-36.
Drug Approvals and Databases. Silver Spring: U.S. Food and Drug Administration (FDA). [cited 2014 Mar 1]. Available from: https://goo.gl/1RqiJX.
Definition and general considerations. Olso: World Health Organization Collaboration Centre for Drug Statistics Methodology. [cited 2014 Mar 1]. Available from: https://goo.gl/qv4t0z.
Micromedex® Solutions. Web application access. Truven Health Analytics Inc. [cited 2014 May 1]. Available from: https://goo.gl/vUGIOL.
WHO Collaboration Centre for Drug Statistics Methodology. ATC/DDD Index 2014. Oslo: WHO; 2014 [cited 2014 Mar 1]. Available from: https://goo.gl/dk5qY7.
Colombia. Comisión de Regulación en Salud. Acuerdo 29 de 2011 (diciembre 28): Por el cual se sustituye el Acuerdo 28 de 2011 que define, aclara y actualiza integralmente el Plan Obligatorio de Salud. Bogotá, D.C.: Diario Oficial 48298; diciembre 30 de 2011 [cited 2013 Mar]. Available from: https://goo.gl/wm3SDy.
Vacca-González CP, Fitzgerald JF, Bermúdez JAZ. Definición de medicamento genérico ¿un fin o un medio? Análisis de la regulación en 14 países de la Región de las Américas. Rev. Panam. Salud Publica. 2006;20(5):314-23. http://doi.org/dvjm8x.
Cullen W, Murray P, Harnett A. Generic statins: effectiveness, affordability, and patient adherence. Ann. Intern. Med. 2014;161(6):447-8. http://doi.org/bsjw.
Kaplan WA, Ritz LS, Vitello M, Wirtz VJ. Policies to promote use of generic medicines in low and middle income countries: a review of published literature, 2000-2010. Health Policy. 2012;106(3):211-24. http://doi.org/bsjx.
Kohli E, Buller A. Factors influencing consumer purchasing patterns of generic versus brand name over-the-counter drugs. South Med. J. 2013;106(2):155-60. http://doi.org/bsjz.
Morgan NA, Rowett D, Currow DC. Analysis of drug interactions at the end of life. BMJ Support Palliat. Care. 2015;5(3):281- 6. http://doi.org/bsj2.
Gutiérrez F, Amariles P, Galindo J, Mueses H, Agudelo J, Hincapié J. Efectividad y seguridad del esquema genérico lamivudina/zidovudina/efavirenz en pacientes VIH (+). Estudio fase IV y comparación con el mismo esquema de medicamentos innovadores. Vitae. 2013;20(1):30-40.
Medina AP, Olaya FJ, Navas MP, Tilano AM, Muñoz E. Estudio de bioequivalencia de montelukast en tabletas masticables de 5 mg. Biomedica. 2012;32(3):399-407. http://doi.org/bsj4.
Colombo GL, Agabiti-Rosei E, Margonato A, Mencacci C, Montecucco CM, Trevisan R. Off-patent generic medicines vs. off-patent brand medicines for six reference drugs: a retrospective claims data study from five local healthcare units in the Lombardy Region of Italy. PLoS One. 2013;8(12):e82990. http://doi.org/bsj5.
Keenum AJ, Devoe JE, Chisolm DJ, Wallace LS. Generic medications for you, but brand-name medications for me. Res. Social Adm. Pharm. 2012;8(6):574-8. http://doi.org/bsj6.
García AM. State laws regulating prescribing of controlled substances: balancing the public health problems of chronic pain and prescription painkiller abuse and overdose. J. Law Med. Ethics. 2013;41(Suppl 1):42-5. http://doi.org/bsj7.
Yahalom Z, Shani S. [Prescribing information for drugs--legal and regulatory implications]. Harefuah. 2014;153(11):671-4.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2017 Revista de la Facultad de Medicina

Esta obra está bajo una licencia Creative Commons Reconocimiento 3.0 Unported.
-





















