The past, present and near future of materials for use in biodegradable orthopaedic implants
Pasado, presente y futuro cercano de los materiales para uso en implantes óseos biodegradables
DOI:
https://doi.org/10.15446/ing.investig.v31n2.23471Keywords:
biomaterial, orthopaedic implant, biodegradability, bone regeneration. (en)biomateriales, implantes ortopédicos, biodegradabilidad, regeneración ósea. (es)
Downloads
The aim of bone replacement or fracture treatment methodologies is to induce tissue regeneration respecting anatomy and try to recover functionality. This goal was initially achieved in the 17th century by using animal or human grafts and several medical devices made of natural and synthetic materials are currently used having a whole range of chemical and physical properties. Research in this field continues to seek a solution to the disadvantages usually found when using grafts: immunological reactions, the risk of microbiological contamination, the absence of donors, the need for several surgical interventions and the risk of disease transmission. Basic and applied research must thus be carried out not only in the development of biology and studies about embryonic stem cells but also in the field of new material development. This tendency may be clearly detected by looking at the vast numbers of studies related to using metallic, polymer and ceramic materials and, at present, compound or hybrid materials having potential use in orthopaedic implants. Most of them fulfil conditions regarding biocompatibility and non-toxicity and could be considered when designing biodegradable materials thereby making it feasible to identify a range of research subjects on biomaterials. This paper starts by identifying material development periods and then establishes the advantages and disadvantages of groups which have been considered for bone regeneration and identifies some guidelines which should be taken into account in the field of biodegradable materials in the near future. There is still a long way to go in this subject, especially regarding the field of materials science and technology
El manejo de fracturas y defectos óseos procura la regeneración del tejido óseo respetando su anatomía y buscando recuperar su funcionalidad. El logro de este objetivo se inició en el siglo XVII con el uso de injertos de origen animal o humano, y ha llegado en la actualidad al uso de implantes, dispositivos elaborados en materiales naturales o sintéticos que comportan una gran variedad de propiedades químicas, físicas y biológicas. Las investigaciones en el área continúan encaminándose a la solución de los inconvenientes que presentan los injertos: las reacciones inmunológicas, los riesgos de contaminación, la ausencia de donantes, la necesidad de varias intervenciones quirúrgicas y el riesgo de transmisión de enfermedades. Es por ello que, tanto la investigación básica como aplicada, se han encaminado de igual forma en el ámbito de la biología del desarrollo e investigación con células madre, como en el campo del exploración de nuevos biomateriales. Esta tendencia es evidente al observar los numerosos estudios en relación con el uso de materiales metálicos, poliméricos, cerámicos y, en la actualidad, de los materiales compuestos o híbridos con uso potencial en implantes ortopédicos. Muchos de estos materiales, al cumplir con condiciones de biocompatibilidad y toxicidad, pueden ser usados en el diseño de materiales biodegradables y son el elemento de partida para el surgimiento de numerosas líneas de investigación en biomateriales. En este documento, a partir de la identificación de los períodos de avance en el estudio de biomateriales, se reseñan las bondades y restricciones de estos diferentes grupos que han sido investigados para ser usados en regeneración ósea y se plantean las directrices que a mediano plazo se han de seguir en el campo de los materiales biodegradables, temática en la que hay un extenso camino por recorrer en el ámbito de la ciencia y tecnología de los materiales.
Pasado, presente y futuro cercano de los materiales para uso en implantes óseos biodegradables
The past, present and near future of materials for use in biodegradable orthopaedic implants
Clara Eugenia Plazas Bonilla1, Jairo Ernesto Perilla2
1 Química Farmacéutica, D.E.A Ciencia y Tecnología de Alimentos, Estudiante Doctorado Ciencia y Tecnología de Materiales. Profesor asistente, Universidad Nacional de Colombia, Colombia. ceplazasb@unal.edu.co
2 Ingeniero Químico, Magíster en Ingeniería Química, Ph D. en Ingeniería de Polímeros. Profesor Asociado, Universidad Nacional de Colombia. jeperillap@unal.edu.co
RESUMEN
El manejo de fracturas y defectos óseos procura la regeneración del tejido óseo respetando su anatomía y buscando recuperar su funcionalidad. El logro de este objetivo se inició en el siglo XVII con el uso de injertos de origen animal o humano, y ha llegado en la actualidad al uso de implantes, dispositivos elaborados en materiales naturales o sintéticos que comportan una gran variedad de propiedades químicas, físicas y biológicas. Las investigaciones en el área continúan encaminándose a la solución de los inconvenientes que presentan los injertos: las reacciones inmunológicas, los riesgos de contaminación, la ausencia de donantes, la necesidad de varias intervenciones quirúrgicas y el riesgo de transmisión de enfermedades. Es por ello que, tanto la investigación básica como aplicada, se han encaminado de igual forma en el ámbito de la biología del desarrollo e investigación con células madre, como en el campo del exploración de nuevos biomateriales. Esta tendencia es evidente al observar los numerosos estudios en relación con el uso de materiales metálicos, poliméricos, cerámicos y, en la actualidad, de los materiales compuestos o híbridos con uso potencial en implantes ortopédicos. Muchos de estos materiales, al cumplir con condiciones de biocompatibilidad y toxicidad, pueden ser usados en el diseño de materiales biodegradables y son el elemento de partida para el surgimiento de numerosas líneas de investigación en biomateriales. En este documento, a partir de la identificación de los períodos de avance en el estudio de biomateriales, se reseñan las bondades y restricciones de estos diferentes grupos que han sido investigados para ser usados en regeneración ósea y se plantean las directrices que a mediano plazo se han de seguir en el campo de los materiales biodegradables, temática en la que hay un extenso camino por recorrer en el ámbito de la ciencia y tecnología de los materiales.
Palabras clave: biomateriales, implantes ortopédicos, biodegradabilidad,regeneración ósea.
ABSTRACT
The aim of bone replacement or fracture treatment methodologies is to induce tissue regeneration respecting anatomy and try to recover functionality. This goal was initially achieved in the 17th century by using animal or human grafts and several medical devices made of natural and synthetic materials are currently used having a whole range of chemical and physical properties. Research in this field continues to seek a solution to the disadvantages usually found when using grafts: immunological reactions, the risk of microbiological contamination, the absence of donors, the need for several surgical interventions and the risk of disease transmission. Basic and applied research must thus be carried out not only in the development of biology and studies about embryonic stem cells but also in the field of new material development. This tendency may be clearly detected by looking at the vast numbers of studies related to using metallic, polymer and ceramic materials and, at present, compound or hybrid materials having potential use in orthopaedic implants. Most of them fulfil conditions regarding biocompatibility and non-toxicity and could be considered when designing biodegradable materials thereby making it feasible to identify a range of research subjects on biomaterials. This paper starts by identifying material development periods and then establishes the advantages and disadvantages of groups which have been considered for bone regeneration and identifies some guidelines which should be taken into account in the field of biodegradable materials in the near future. There is still a long way to go in this subject, especially regarding the field of materials science and technology.
Keywords: biomaterial, orthopaedic implant, biodegradability, bone regeneration.
Recibido: marzo 10 de 2010
Aceptado: junio 17 de 2011
Introducción
Si se analiza que las enfermedades relacionadas con las articulaciones afectan en forma muy marcada la población mundial, que las enfermedades crónicas en las articulaciones son la mayor causa de incapacidad en adultos mayores y que la osteoporosis afecta a un 50% de la población femenina y a un 25% de la masculina mayor de 50 años, dado que se espera que mundialmente para el año 2020 se incremente en un 100% la población mayor de 50 años (Naciones Unidas, 2004; Carvajal, 2007) y que las fracturas relacionadas con osteoporosis se han prácticamente doblado en los últimos años, la próxima década demanda un avance significativo en el campo de las ciencias musculoesqueléticas (The Bone y Joint Decade, 2009).
La evolución de la investigación en biomateriales se puede describir de la siguiente forma: la primera generación data de los años sesenta-setenta, donde los materiales representativos son el acero y el polietileno, y tuvo como objetivos el logro de propiedades físicas muy similares al tejido a reemplazar y la obtención de un material con el que no reaccionara (Navarro, 2005). La segunda generación tiene relación con el desarrollo de la industria aeronáutica y con materiales como el titanio y sus aleaciones, cuyas características relevantes son la inercia y la pasividad, y que presentan inconvenientes en la adaptación al organismo y la alta probabilidad de rechazo. La tercera generación (años noventa), parte del principio de que no es el cuerpo el que debe adaptarse al material, sino el material el que debe adaptarse al cuerpo (Jacota, 2008). Aparece entonces el término biomaterial activo para designar aquellos materiales que presentan similitudes en composición o en superficie con el sistema biológico, encontrándose como ejemplos característicos los fosfatos de calcio, la hidroxiapatita y los biovidrios (Jacota, 2008; Zárate y Reyes, 2006). La cuarta generación pretende obtener materiales que interactúen en profundidad con los sistemas biológicos mediante la regularización del proceso biológico, integrándose en el organismo y con una capacidad de degradarse y de luchar contra las infecciones. Se denominan materiales inteligentes, ya que adaptan sus propiedades al estímulo exterior o contienen sensores para vigilar las funciones e interactuar con los sistemas biológicos (Jacota, 2008).
El diseño y estudio de materiales para implantes debe considerar que la introducción de un elemento extraño en un organismo vivo crea una interfase entre el material del implante y el tejido, donde se presenta una interacción y efectos debidos a la tensión superficial, a la energía libre de superficie, a las propiedades eléctricas, a la hidrofilicidad y a la presencia de grupos iónicos; interacción relacionada también con la susceptibilidad de contaminación del material debida a la naturaleza de su superficie (Barcellos et al., 1998). Es por ello que un importante segmento de la investigación en materiales para ortopedia se ha dirigido a evaluar las características de biocompatibilidad o ausencia de algún tipo de reacción biológica adversa (Alcaide et al., 2009).
Respecto a la biodegradabilidad, es un fenómeno que debe ocurrir a una velocidad tal que permita el proceso de curación del tejido, por lo que resulta relevante considerar que el material debe permitir una transferencia progresiva de cargas al hueso en recuperación, concomitante con la formación de nuevo tejido, lo que se traduce en un material osteoinductivo, osteorregenerador y osteoconductivo (Pariente et al., 2006). Adicionalmente, las propiedades físicas son otro parámetro esencial en el diseño de estos materiales, puesto que deben poseer una buena resistencia mecánica, un tiempo de fatiga adecuado y una densidad y peso convenientes. Igualmente, deben ser antisépticos o esterilizables, y de procesamiento fácil y reproducible a gran escala, al costo más bajo posible (Navarro, 2005). En general, es la aplicación del material la que determina las propiedades físicas a controlar; en el caso de los materiales cerámicos y poliméricos inyectables usados en técnicas quirúrgicas no invasivas en tejido osteoarticular, resulta importante la caracterización reológica (Fatimi, 2009). Surge a este respecto la consideración relacionada con el comportamiento reológico característico de los tejidos biológicos, donde debe reconocerse que el modelamiento de estas propiedades en los tejidos vivos son el resultado de las propiedades microscópicas de las células, objeto de estudio de difícil realización (Verdier, 2003).
De igual forma, independientemente de la naturaleza química del material, hay una marcada influencia de la estructura y forma del implante (Kong et al., 2007; Likibi et al., 2005), constituyéndose la porosidad y la topografía en factores determinantes para que éste se ligue o no más fácilmente al hueso (Davies, 2007; Kong et al., 2007; Likibi et al., 2005; Navarro, 2005).
Los materiales bioabsorbibles se desarrollaron con el fin de evitar una segunda intervención quirúrgica para la remoción del implante, por lo que deben presentar la rigidez suficiente para que el hueso comience a sanar, manteniendo sus propiedades mecánicas mientras forman el callo óseo para luego iniciar su proceso de degradación (Ambard et al., 2005; Bordenave y Baquey, 2004; Navarro, 2005). La figura 1 resume los principales aspectos a considerar en el diseño de materiales biodegradables para aplicaciones ortopédicas.
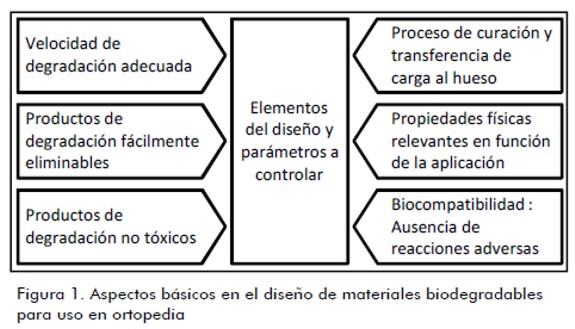
Biomateriales degradables
Los polímeros naturales y sintéticos, las cerámicas y los vidrios biológicos, y algunos metales y aleaciones, son los biomateriales usados para regeneración ósea (Navarro, 2005; Tharanathan, 2003). A continuación se presentan algunos aspectos relevantes de cada uno de ellos, excluyendo los materiales metálicos, ya que no son considerados biodegradables.
Polímeros naturales y sintéticos
Como consecuencia de la preocupación por el desarrollo sostenible, se ha impulsado el avance en el estudio de los materiales con base en biopolímeros, ya sean obtenidos por síntesis química, o como producto del metabolismo de organismos vivos (Bordes et al., 2009), razón por la cual es notable el uso de biopolímeros en el diseño de dispositivos biomédicos (Martins et al., 2008; Pashkuleva et al., 2007; Pavithra y Doble, 2008; Rojas et al., 2008). Si bien los polímeros sintéticos ofrecen ventajas sobre los derivados naturales puesto que pueden ser diseñados en función de las propiedades requeridas (Armelin, 2002; Middleton y Tipton, 2000; Thombre y Sarwade, 2005), los polímeros naturales cubren un segmento importante de la investigación, en razón a ventajas tales como la biocompatibilidad, la facilidad de obtención, el bajo costo y la factibilidad de modificarlos químicamente (Martins et al., 2008; Vaz et al., 2003). Es de resaltar la realización de estudios para la incorporación de polímeros naturales en polímeros sintéticos, con el fin de aumentar su degradabilidad y biocompatibilidad (Armelin, 2002). Entre los biopolímeros naturales y sintéticos con aplicaciones potenciales en implantes se encuentran:
Polisacáridos: los almidones, los productos lignocelulósicos (madera), las pectinas y las gomas se encuentran en esta categoría. El almidón, por ejemplo, es un polímero de carácter fuertemente hidrofílico, de bajo costo y alta disponibilidad, frecuentemente utilizado como aditivo biodegradable (Martins et al., 2008; Pashkuleva et al., 2007). Por su parte, la celulosa es el polímero natural más abundante, razón por la cual ha sido ampliamente investigada como potencial material biodegradable, realizando modificaciones que alteren su estructura (Metabolix, 2009).
Lípidos y proteínas: entre éstos se encuentran la caseína, el colágeno y el suero, provenientes de fuentes animales; y el gluten, la soya y la zeína, de fuentes vegetales.
Poliésteres de origen microbiano o polihidroxialcanoatos (PHA):se acumulan en algunos microorganismos entre un 30 y 80% de su peso celular seco. El PHB (polihidroxibutirato) es el principal homopolímero de esta familia; es un poliéster altamente cristalino que presenta una amplia ventana de procesamiento. Entre los copolímeros se encuentran los poli (hidroxibutirato-cohidroxivalerato) PHBV, los poli (hidroxibutirato-cohidroxihexanoato) PHBHx, los poli (hiydroxibutirato-cohidroxioctanoato) PHBO y los poli (hidroxibutirato-cohidroxioctadecanoato) PHBOd, de amplia aplicación en medicina por su biocompatibilidad (Maia et al., 2004). Las propiedades de los copolímeros pueden variar con el contenido de hidroxivalerato (HV); cuando éste es mayor, se produce un aumento de la resistencia al impacto y una menor temperatura de fusión y de transición vítrea (Bordes et al., 2009).
Poliésteres del ácido láctico: el ácido láctico es una molécula quiral que existe en dos formas esteroisómeras, L y D. Es obtenido por síntesis química a partir de diversas materias primas, o mediante procesos biológicos, siendo el estereoisómero L el más abundante en el monómero de origen biológico (Pan e Inoue, 2009; Anderson y Shive, 1997; Ambrose y Clanton, 2004). La polimerización del ácido láctico por poliesterificación genera normalmente polímeros de bajo peso molecular, que poseen diversas aplicaciones en el campo farmacéutico pero que debido a su limitado comportamiento mecánico no es usado en implantes. Para la obtención de PLA de alto peso molecular normalmente se utiliza el producto intermedio de la degradación controlada del PLA de bajo peso molecular denominado lacturo. El lacturo polimeriza mediante un mecanismo de apertura de anillo, generando polímeros de alto peso molecular. Las propiedades mecánicas y de biodegradación en el PLA pueden manipularse mediante el contenido de unidades de D y L en el polímero (Bordes et al., 2009). El homopolímero derivado del ácido Lláctico es útil en aplicaciones ortopédicas debido a su elevado grado de cristalinidad, alta resistencia a la tensión, baja elongación y elevado módulo; es el sustrato más frecuentemente usado para el cultivo celular, regeneración de tejido y prótesis ortopédicas, y en ingeniería de tejidos debido a sus características atóxicas y buena biocompatibilidad (Santos y Rodríguez, 2009). De igual forma, el PLLA ha sido usado como copolímero con otros polímeros sintéticos o naturales (Shum et al., 2005; Mano et al., 2008). Por su parte, el polímero con unidades D y L, al ser amorfo, presenta una baja resistencia a la tensión, alta elongación y elevada velocidad de degradación (Armelin, 2002). En estudios realizados durante el tratamiento de fracturas en los que se usaron elementos de fijación tales como varillas, alambres y tornillos elaborados en polímeros derivados del ácido láctico, se reportó que en un alto porcentaje de los casos no hubo complicaciones y se concluyó que éstos son ventajosos puesto que no requieren una segunda intervención quirúrgica (Rokkanen et al., 2000).
La policaprolactona (PCL): se obtiene por polimerización de ε- caprolactona, en presencia de alcóxidos metálicos; es biodegradable y semicristalino (Bordes et al., 2009; Peña et al., 2006). Es un polímero bastante utilizado en suturas biodegradables, y para aumentar su velocidad de degradación se ha combinado en copolímeros con D-L láctico (Metabolix, 2009). Se emplea limitadamente debido a su baja temperatura de transición vítrea y bajo punto de fusión, pero tiene la ventaja de degradarse fácilmente por medios enzimáticos.
Otros polímeros de origen sintético que presentan propiedades de biodegradación incluyen: poliésteres alifáticos, copoliésteres aromáticos y poliesteramidas (Armelin, 2002).
Materiales cerámicos
Existe un gran interés en el uso de estos materiales para reconstrucción ósea (Martínez et al., 2008) debido a su potencial bioactividad, la cual está fundamentada en la semejanza estructural que presentan con la fase mineral del hueso y la reacción bioquímica positiva que producen en la interfase cerámica-hueso. Las apatitas, y más específicamente la hidroxiapatita, aunque presentan alta fragilidad, poseen buenas propiedades físicas, como son la resistencia a la temperatura, a la corrosión, al desgaste, y una elevada dureza. Por su parte, la alúmina y la zirconia, denominadas cerámicas bioinertes (Jacota, 2008) tienen aplicación en ortopedia por ser muy resistentes al desgaste. Se usan en prótesis articulares, en cementos óseos para el relleno de pequeños defectos, en materiales reabsorbibles para la estimulación de la regeneración ósea y en recubrimiento de implantes metálicos (Navarro, 2005). Las cerámicas biodegradables pueden clasificarse en cerámicas de fosfato de calcio y biovidrios.
Cerámicas de fosfato de calcio (hidroxiapatitas): son sustitutos interesantes en implantes del sistema óseo por su buen comportamiento histológico (Pereda, 2005) y su desempeño in vivo, que depende de factores tales como la relación calcio/fósforo (Ca/P), la estructura cristalográfica y la porosidad. Dependiendo de la aplicación, se usan diferentes fases, cuya estabilidad se ve intensamente influenciada por la temperatura y la presencia de agua. Es importante resaltar que la forma y tamaño de la partícula son características importantes de la respuesta biológica de los implantes de hidroxiapatita y que su resistencia a la tensión, a la compresión y a la fatiga dependen de la porosidad del material. En general, se usa en forma de gránulos para implantes pequeños que no soporten altas cargas, como son los del oído medio; como material poroso para estimular el crecimiento del hueso; o en cementos, que se implantan en estado pastoso y fraguan in vivo (Fernández, 2005; Laquerriere et al., 2005).
Biovidrios: son materiales amorfos cuya estructura vítrea se produce por la unión de los tetraedros de un grupo iónico determinado para formar una estructura reticular no cristalina, es decir, no presenta periodicidad de largo alcance dentro de la red. De los cuatro óxidos formadores de vidrios clásicos propuestos por Zachariesen: SiO2, GeO2, B2O3 y P2O5, los más conocidos como óxidos formadores de red son el óxido de silicio (SiO2) y el pentóxido de fósforo (P2O5), dando origen a los vidrios de base SiO2 y de base P2O5. En general, se caracterizan por su hemocompatibilidad, su adaptación a la composición de la fase mineral del hueso y por la modificación que se puede realizar a su velocidad de degradación en función de la composición química. Entre sus aplicaciones clínicas están la liberación de iones antibacteriales (el cobre, la plata) y en odontología para la liberación de flúor (Navarro, 2005).
Materiales compuestos o híbridos
Mediante la aplicación y manejo de la química de polímeros, e incorporando tecnologías como el electrospinning, se pueden fabricar un amplio abanico de estructuras; además, con la aplicación de recubrimientos bioactivos o nanopartículas en la superficie de los materiales es posible obtener nanocompuestos con propiedades mecánicas adecuadas que puedan mejorar la respuesta del organismo al material y por tanto sustituir los materiales utilizados actualmente (Fundación OPTI, 2008, Chen et al., 2010). Si bien los poliésteres biodegradables aceptados por la Food and Drug Administration (FDA) degradan por autocatálisis y pierden rápidamente sus propiedades mecánicas, se han propuesto materiales que degraden más lentamente mediante la selección del polímero de partida y el desarrollo de nanomateriales híbridos orgánicos-inorgánicos que involucren cerámicas o vidrios bioactivos sintetizados por procesos sol-gel, cuyo objetivo es el de conferir al material excelentes propiedades biológicas (Baino y Vitale- Brovarone, 2011; Valliant y Jones, 2011).
Nanocompuestos poliméricos reforzados con arcillas o materiales inorgánicos
Los polímeros pueden reforzarse dispersando en ellos compuestos inorgánicos, lo que permite combinar las ventajas relacionadas con el procesamiento de la matriz polimérica y las características favorables de los rellenos, como son un alto módulo y una alta resistencia a la oxidación y a la temperatura (Wu y Mather, 2009). Las arcillas comúnmente empleadas en la obtención de nanocompuestos poliméricos pueden clasificarse de acuerdo con su morfología; las más usadas son la montmorilonita y la saponita. Los tamaños y relación de tamaños de partícula de las arcillas, permiten modificar las propiedades de los biopolímeros, produciendo los llamados nanobiocompuestos, los cuales presentan buena biodegradabilidad (Li et al., 2008). De esta manera, es posible obtener una amplia variedad de materiales, entre los que cabe citar los denominados silicatos en capas organomodificadas u OMLS, elaborados con base en diferentes biopolímeros, diferentes arcillas, diversos organocompuestos y aplicando distintas rutas de fabricación, logrando así mejorar algunas de las propiedades de cada uno de los materiales independientes (Bordes et al., 2009).
Aplicación de tratamientos superficiales
Una herramienta importante en el campo de los biomateriales para implantes son los recubrimientos en película que se emplean con el fin de modificar la superficie de los materiales óseos (Goto, 2005), ya que producen cambios en la topografía, la composición y la humectabilidad de los materiales, y promueven la unión de éstos a los osteoblastos, ayudando en la formación de la matriz mineral (Advincula et al., 2006; Chai y Ben-Nissan, 1999; Pavithra y Doble, 2008). Las bajas temperaturas requeridas y la alta adherencia de los recubrimientos son características que entre una gran variedad de procesos han justificado el uso de la técnica sol-gel (Lu et al., 2007) y la proyección térmica (Gaona, 2007). Si bien no todos los tipos de tratamientos son aplicables en el campo de los biomateriales para implantes óseos, a continuación se presentan los tratamientos más relevantes en esta área:
Tratamientos fisicoquímicos: confieren protección o activación de la superficie. Se encuentran en este grupo las técnicas PVD (deposición física en fase de vapor), CVD (deposición química en fase de vapor), la implantación iónica, el sputtering, el depósito pulsado, la ablación láser y la pulverización iónica.
Tratamientos químicos: modifican la composición química de la superficie del material de partida, e incluyen en este grupo los tratamientos ácidos, alcalinos, y los tratamientos electroquímicos. Pertenece a esta categoría la técnica sol-gel usada para la síntesis de películas cerámicas sobre superficies de biomateriales tales como el titanio o el titanio modificado. En la técnica sol-gel la elección de los precursores y las variaciones en la técnica de formación del gel permiten controlar la composición, la estructura y la homogeneidad de las películas cerámicas de interés biológico, como son el óxido de titanio, los biovidrios y el fosfato de calcio (Chai y Ben-Nissan, 1999; Jacota, 2008; Uhlmann et al., 1997). Es un buen procedimiento para mejorar la biocompatibilidad, la rigidez y la bioactividad de las estructuras, y para prevenir la corrosión en implantes metálicos. Por otra parte, el uso de silanos orgánicamente modificados (ORMOSILS) obtenidos por esta técnica produce materiales bioactivos para reemplazo óseo, campo en el que la investigación se ha encaminado hacia la mejora de la integración entre el sustrato y la capa de recubrimiento (Gupta y Kumar, 2008; Schottner, 2001; Zarzycki, 1997).
Tratamientos biológicos: la superficie del material puede ser también funcionalizada ligándola a moléculas bioactivas que controlen la adhesión celular y que a su vez permitan inducir una respuesta celular por inmovilización de péptidos, proteínas y factores de crecimiento.
Materiales con respuesta biológica
Con el fin de optimizar las propiedades físicas, químicas y biológicas, se han incorporado biomoléculas en los andamiajes de materiales con diversas aplicaciones biomédicas, así como para activar biológicamente sus superficies (Akkouch, 2008). Se pueden identificar dos tendencias en el desarrollo de materiales con características de bioactividad, bioabsorbabilidad, capaces de estimular la respuesta celular y molecular en forma controlada, y que actúen como soportes temporales en la reparación de defectos óseos (Yoshida et al., 2006). La primera consiste en el desarrollo de andamiajes tridimensionales acelulares, que sirvan para alojar las diferentes células una vez implantados in vivo, y la segunda plantea la colonización inicial de los andamiajes por células progenitoras bajo condiciones in vitro, para luego ser implantados y reemplazar el tejido dañado (Navarro, 2005).
Conclusiones
La medicina regenerativa exige disponer de una enorme capacidad para cambiar la forma de tratamiento de muchas enfermedades, entre ellas la del sistema esquelético. Aun cuando uno de los objetivos de los estudios en esta línea de la medicina es explorar el potencial reparador de las células madre adultas, un propósito de la investigación en este campo, al cual la nanotecnología debe apuntar para ofrecer terapias basadas en ingeniería de tejidos, es la aplicación de polímeros reabsorbibles y de materiales que imiten los diferentes tipos de matrices extracelulares presentes en los tejidos, así como el uso de andamiajes que una vez implantados puedan reabsorberse y finalmente restituir el tejido lesionado por un nuevo tejido donde ocurra una renovación de conexiones sanguíneas y nerviosas.
Dado que las propiedades requeridas de un material están definidas en función de su aplicación específica y de la naturaleza de su interaccióón con el tejido adyacente, el desconocimiento de esta interacción puede desencadenar por parte del organismo respuestas de rechazo a los implantes, por lo que en el desarrollo, diseño y caracterización se debe involucrar, además d la caracterización física y química del material, la evaluación de la interacción biológica, que permita inferir propiedades de bioabsorbabilidad, bioactividad y biocompatibilidad.
Ha tomado gran relevancia la tendencia al uso de materiales compuestos, opción prometedora en la elaboración de implantes biodegradables para regeneración ósea, donde resulta importante tanto la elección del polímero como la incorporación de componentes bioactivos en lo molecular que al formar una estructura porosa permitan el crecimiento celular y la transferencia de nutrientes. Se augura un largo camino por recorrer, ya que no se han reportado hasta el momento andamiajes con una relación de propiedad mecánica y estructural que simulen las del hueso trabecular o cortical. A este respecto, los polímeros biodegradables naturales y sintéticos ofrecen una alternativa interesante debido a su biocompatibilidad y a la posibilidad de ser metabolizados una vez el tejido óseo se haya regenerado; y a que combinados con materiales cerámicos, tales como los biovidrios y la hidroxiapatita, presentan características que favorecen la regeneración ósea. Estas características son las que han desencadenado una tendencia al estudio de materiales híbridos o compuestos, pues se puede lograr mejorar las propiedades individuales de los materiales involucrados, ya sea por medio de modificaciones o mediante la aplicación de la química y la física a la ingeniería de tejidos.
Finalmente, las consideraciones a tener en cuenta en la evolución de nuevos materiales para la elaboración de implantes biodegradables se resumen en: el imprescindible control de las interacciones de las entidades célula/célula, célula/proteína y proteína/superficie; y la combinación de propiedades específicas de materiales individuales que contribuyan al desarrollo de nuevos materiales y permitan la optimización de su desempeño final.
Referencias
Advincula, M., Rahemtulla, F., Advincula R., Ada E., Lemons J., Bellis S., Osteoblast adhesion and matrix mineralization on sol-gel-derived titanium oxide., Biomaterials, Vol. 27, No 10, 2006, pp. 2201-2212.
Akkouch, A., Incorporation de Fibronectine et d'albumine de sérum bovin à un biopolyère composé de Polypyrrole et de Poly (l-acide lactique) pour promouvoir la régénération tissulaire., tesis presentada a la Universidad de Laval, para optar el grado de Maestro en Ciencias en Medicina Experimental, 2008.
Alcaide, M., Serrano, M., Pagani, R., Sanchez, S., Vallet, M., Portoles, M., Biocompatibility markers for the study of interactions between osteoblasts and composite biomaterials., Biomaterials, Vol. 30, No 1, 2009, pp. 45-51.
Ambard, D., Le-Lez, S., Pedrono, A., Swider, P., Un modèle de prévision de cicatrisation de linterface os-implant., ITBMRBM, Vol. 26, No 1, 2005, pp. 117-126.
Ambrose, C., Clanton, T., Bioabsorbable Implants: Review of Clinical Experience in Orthopedic Surgery Department of Orthopedic Surgery., Annals of Biomedical Engineering, Vol. 32, No 1, 2004, pp. 171-177.
Anderson, J., Shive, M., Biodegradation and biocompatibility of PLA and PLGA microspheres., Advanced Drug Delivery Reviews, Vol. 28, No 1, 1997, pp. 5-24.
Armelin, E., Síntesis y Caracterización de nuevas poliesteramidas: Estudio de sus propiedades., tesis presentada a la Universi- Universidad Politécnica de Cataluña, para optar el grado de Doctor en Ciencias, 2002.
Baino, F., Vitale-Brovarone, C., Three-dimensional glass derived scaffolds for bone tissue engineering: Currents trends and forecast for the future., Journal of Biomedical Materials Research A, Vol. 97A, No 4, 2011.
Barcellos, I., Carobrez, S., Pires, A., Alvarez, M., In vivo and in vitro responses to poly (ethylene terephthalate-co-diethylene glycol terephthalate) and polyethylene oxide blends., Biomaterials, Vol. 19, No 22, 1998, pp. 2075-2082.
Bordenave, L., Baquey, C., Médecine nucléaire et prothèses., Médecine Nucléaire - Imagerie fonctionnelle et métabolique, Vol. 28, No 12, 2004, pp 623-630.
Bordes, P., Pollet, E., Avérous, L., Nano-biocomposites: Biodegradable polyester/nanoclay systems., Progress in Polymer Science, Vol. 34, 2009, pp. 125-155.
Carvajal, M., Las caídas y fracturas de cadera en el adulto mayor., Revista Medica de Costa Rica y Centroamérica, Vol. LXIV, No 581, 2007, pp. 199-202.
Chai, C., Ben-Nissan, B., Bioactive nanocrystalline sol-gel hydroxyapatite coatings., Journal of Materials Science: Materials in Medicine, Vol. 10, No 8, 1999, pp. 465-469.
Chen, S., Osaka, A., Hayakawa, S., Shirosaki, Y., Tsuru, K., Morphology and structure of organosilica hybrid particles derived from tetramethoxysilane and viniltrimetoxisilane via catalyst-free sol-gel route., Journal of Materials Chemistry, Vol. 20, 2010, pp. 7337-7339.
Davies J., Bone bonding at natural and biomaterial surfaces., Biomaterials, Vol. 28, No 34, 2007, pp. 5058-5067.
Fatimi, A., Comportement rhéologique de biomatériaux pour lingénierie ostéoarticulaire et dentaire: matrices extracellulaires synthétiques et suspensions phosphocalciques., IRBM, Vol. 30, No 3, 2009, pp. 139 -140.
Fernández, E., Obtención y caracterización de nuevos cementos óseos de fosfatos de calcio en el sistema CaHPO4-Ca3 (PO4)2., tesis presentada a la Universidad Politécnica de Cataluña, para optar el grado de Doctor en Ciencias de los Materiales, 2005.
Fundación OPTI., Ministerio de Industria, Turismo y Comercio, Gobierno de España, Observatorio de Prospectiva Tecnológica Industrial, Aplicaciones Industriales de las Nanotecnologías en España en el Horizonte 2020., España, 2008. On line at http://www.navarrainnova.com/pdf/2009/ nanoindustrial2020OPTI.pdf, Consultado Julio 2011.
Gaona, M., Recubrimientos biocompatibles obtenidos por Proyección Térmica y estudio in vitro de la función osteoblástica., tesis presentada a la Universidad de Barcelona para optar el grado de Doctor en Ciencias Químicas, 2007.
Goto, T., Surface coating technology for biomaterials- morphology and nanostructure., Control International Congress Series, Vol. 1284, 2005, pp 248-256.
Gupta, R., Kumar, A., Bioactive materials for biomedical applications using sol-gel technology., Biomedical Materials, Vol. 3, No. 3, 2008, pp1-15.
Jacota, S., Films Minces de Dioxyde de Titane Déposés sur Titane par MOCVD: Microstructure et Biocompatibilité., tesis presentada a la Universidad de Toulouse, para optar el grado de Doctor en Ciencia e Ingeniería de Materiales, 2008.
Kong, L., Ao, Q., Wang, A., Gong, K., Wang, X., Lu, G., Gong, Y., Zhao, N., Zhang, X., Preparation and Characterization of a Multilayer Biomimetic Scaffold for Bone Tissue Engineering., Journal of Biomaterials Applications, Vol. 22, No. 3,2007, pp 223-239.
Laquerriere, P., Grandjean-Laquerriere, A., Jallot, E., Nardin, M., Frayssinet, P., Nedelec, J.M., Laurent-maquin, D., Influence des propriétés physico-chimiques d'hydroxyapatites sur le comportement cellulaire., Revue Européenne de Technologie Biomédicale, Vol. 26, No 3, 2005, pp. 200-205.
Li, H., Zhai, W., Chang, J., Effects of Wollastonite on Proliferation and Differentiation of Human Bone Marrow-derived Stromal Cells in PHBV/Wollastonite Composite Scaffolds., Journal of Biomaterials Applications, Vol. 00, 2008, pp. 1- 16.
Likibi, F., Assad, M., Coillard, C., Chabot, G., Rivard, C., Intégration et apposition osseuses des biomatériaux orthopédiques métalliques poreux et non poreux., Annales de chirurgie, Vol. 130, No 4, 2005, pp. 235-241.
Lu, X., Wang, Y., Liu, Y., Wang J., Qu S., Feng, B., Weng J., Preparation of HA/chitosan composite coatings on alkali treated titanium surfaces through sol-gel techniques, Materials Letters, Vol. 61, No. 18, 2007, pp. 3970-3973.
Maia, J., Santana, M., Re, M., The effect of some processing conditions on the characteristics of biodegradable microspheres obtained by an emulsion solvent evaporation process, Braz., Journal of Chemical and Engineering, Vol. 21, No. 1, 2004, pp. 1-12.
Mano, J. F., Hungerford G., Gomez, J.L., Bioactive Poly (L-Lactic Acid)-Chitosan Hybrid Scaffolds., Materials Science and Engineering C, Vol. 28, No 8, 2008, pp. 1356-1365.
Martínez, A., Esparza, H., Carvajal, G., Ortiz, J., Caracterización estructural y morfológica de hidroxiapatita nanoestructurada: estudio comparativo de diferentes métodos de síntesis., Superficies y Vacío, Vol. 21, No 4, 2008, pp. 18-21.
Natural origin scaffolds with in situ pore forming capability for bone tissue engineering applications., Acta Biomaterialia, Vol. 4, No 6, 2008, pp. 1637-1645.
Metabolix Bioindustries Evolution., Bioplásticos. On line at http://www.metabolix.com, Consultado Nov. 2009.
Middleton, J., Tipton, A., Synthetic biodegradable polymers as orthopedic devices., Biomaterials, Vol. 21, 2000, pp. 2335- 2346.
Navarro, M., Desarrollo y caracterización de materiales biodegradables para regeneración ósea., tesis presentada a la Universidad Politécnica de Cataluña para optar el grado de Doctor en Ciencias, 2005.
Pan, P., Inoue, Y., Polymorphism and isomorphism in biodegradable polyesters., Progress in Polymer Science, Vol. 34, No 7, 2009, pp. 605-640.
Pariente, J., Bordenave, L., Villars, F., Renard, M., Delmond, S., ricain, J., Baquey, C., Centre d'innovations technologiques biomatériaux du CHU de Bordeaux., ITBM-RBM, Vol. 27, No 4, 2006, pp. 150-155.
Pashkuleva, I., Azevedo, H., Reis, R., Surface Structural Investigation of Starch-Based, Macromol. Biosci., Vol. 8, No. 2, 2007, pp. 210-219.
Pavithra, D., Doble, M., Biofilm formation, bacterial adhesion and host response on polymeric implants-issues and prevention., Biomed. Mater. Vol. 3, No 3, 2008, pp. 1-13.
Peña, J., Corrales, T., Izquierdo, I., Doadrio, A., Vallet, M., Long term degradation of poly(3-caprolactone) films in biologically related fluids., Polymer Degradation and Stability, Vol. 91, No 7, 2006, pp. 1424 -1432.
Pereda, O., Metodología de empleo de la hidroxiapatita coralina HAP-200 en Ortopedia y Traumatología., Rev. Cubana Ortop. Traumatol., Vol 19, No 1, 2005, pp. 35-40.
Rodriguez Santos Jr, A., Analysis of the Growth Pattern of Vero Cells Cultured on Dense and Porous Poly (L-Lactic Acid) Scaffolds., Materials Research, Vol. 12, No 3, 2009 pp. 257-263.
Rojas, M., Vallejo, B., Perilla, J. E., Los biopolímeros como materiales para el desarrollo de productos en aplicaciones farmacéuticas y de uso biomédico, Ingeniería e Investigación, Vol. 28, No 1, 2008, pp. 57-71.
Rokkanen, P., Böstman, O., Hirvensalo, E., Makela, E., Partio, E., Patiala, H., Vainionpaa, S., Vihtonen, K., Tormala, P., Bioabsorbable fixation in orthopaedic surgery and traumatology., Biomaterials, Vol. 21, No 24, 2000, pp.2607-2613.
Schottner, G., Hybrid Sol-Gel-Derived Polymers: Applications of Multifunctional Materials., Chemistry of Materials, Vol. 13, No 10, 2001, pp. 3422-3435.
Shum, A. W. T., Li, J., Mak A. F. T., Fabrication and Structural Characterization of Porous Biodegradable Poly(DL-Lactic-Co-Glycolic Acid) Scaffolds with Controlled Range of Pore Sizes., Polymer Degradation and Stability, Vol. 87, No. 3, 2005, pp.487-493.
Tharanathan, R., Biodegradable films and composite coatings: past, present and future., Trends in Food Science & Technology, Vol. 14, No 3, 2003, pp. 71-78.
The Bone and Joint Decade 2000-2010., Report 2009. On line at http://www.boneandjointdecade.org/HTML/musconline/images/BJD%20annual%20report%202009.pdf, Consultado Julio 2011.
Thombre, S., Sarwade, B., Synthesis and Biodegradability of Polyaspartic Acid: A Critical Review, Journal of Macromolecular Science., Part A: Pure and Applied Chemistry, Vol. 42, No. 9, 2005, pp. 1299-1315.
Uhlmann, D., Teowee, G., Boulton, J., The Future of Sol-Gel Science and Technology., Journal of Sol-Gel Science and Technology, Vol. 8, No 1-3, 1997, pp. 1083-1091.
United Nations, Department of Economic and Social Affairs, World Population Prospects., Revision: Analytical Report, 2004. On line at http://www.un.org/esa/population/publications/WPP2004/2004Highlights_finalrevised.pdf, Consultado Julio 2011.
Valliant, E., Jones, J., Softening bioactive glass for bone regenerative sol-gel hybrid materials., Soft Matter, Vol. 7, 2011, pp. 5083-5095.
Vaz, C., de Graaf, L., Reis, R., Cunha, A., In vitro degradation behavior of biodegradable soy plastics: effects of crosslinking with glyoxal and thermal treatment., Polymer Degradation and Stability, Vol. 81, 2003, pp. 65-74.
Verdier, C., Rheological Properties of Living Materials. From Cells to Tissues., Journal of Theoretical Medicine, Vol. 5, No 2, 2003, pp. 67-91.
Wu, J., Mather, P., POSS Polymers: Physical Properties and Biomaterials Applications., Polymer Reviews, Vol. 49, No 1, 2009, pp. 25-63.
Yoshida, M., Langer, R., Lendlein, A., Lahann, J., From Advanced Biomedical Coatings to Multi-Functionalized Biomaterials., Polymer Reviews, Vol. 46, No 4, 2006, pp. 347- 375.
Zárate, B., Reyes, A., Injertos óseos en cirugía ortopédica., Cirugía y Cirujanos, Vol. 74, No 3, 2006, pp. 217- 222.
Zarzycki, J., Past and Present of Sol-Gel Science and Technology., Journal of Sol-Gel Science and Technology, Vol. 8, No. 1-3, 1997, pp. 17-22.
The past, present and near future of materials for use in biodegradable orthopaedic implants
Clara Eugenia Plazas Bonilla1, Jairo Ernesto Perilla2
1 Pharmaceutical Chemistry, DEA Food Science and Technology, Doctoral Student of Materials Science and Technology. Assistant Professor, Universidad Nacional de Colombia, Colombia. ceplazasb@unal.edu.co
2 Chemical Engineering, Masters in Chemical Engineering, Ph.D. Engineering Polymers. Associate Professor, Universidad Nacional de Colombia. jeperillap@unal.edu.co,
ABSTRACT
The aim of bone replacement or fracture treatment methodologies is to induce tissue regeneration respecting anatomy and try to recover functionality. This goal was initially achieved in the 17th century by using animal or human grafts and several medical devices made of natural and synthetic materials are currently used having a whole range of chemical and physical properties. Research in this field continues to seek a solution to the disadvantages usually found when using grafts: immunological reactions, the risk of microbiological contamination, the absence of donors, the need for several surgical interventions and the risk of disease transmission. Basic and applied research must thus be carried out not only in the development of biology and studies about embryonic stem cells but also in the field of new material development. This tendency may be clearly detected by looking at the vast numbers of studies related to using metallic, polymer and ceramic materials and, at present, compound or hybrid materials having potential use in orthopaedic implants. Most of them fulfil conditions regarding biocompatibility and non-toxicity and could be considered when designing biodegradable materials thereby making it feasible to identify a range of research subjects on biomaterials. This paper starts by identifying material development periods and then establishes the advantages and disadvantages of groups which have been considered for bone regeneration and identifies some guidelines which should be taken into account in the field of biodegradable materials in the near future. There is still a long way to go in this subject, especially regarding the field of materials science and technology.
Keywords: biomaterial, orthopaedic implant, biodegradability, bone regeneration.
Received: March 10th 2010
Accepted: June 17th 2011
Introduction
Diseases related to articulations noticeably affect the world’s population; chronic articulation diseases are the main cause of disability in older adults and osteoporosis affects 50% of the female population and 25% of the male population aged over 50. Given that it is expected that the world population over 50 years old will increase by 100% in 2020 (United Nations, 2004; Carvajal, 2007) and that osteoporosis-related fractures have almost doubled in recent years, then the next decade will require a significant advance in the field of skeletal muscle sciences (The Bone and Joint Decade, 2009).
The evolution of biomaterial research can be described as follows. The first generation dated from the 1960s to 1970s where steel and polyethylene were the classic materials, aimed at achieving very similar physical properties to the tissue being replaced and where the aim was to obtain a material which did not react with organic tissue (Navarro, 2005). The second generation was linked to the development of the aeronautics industry and materials such as titanium and its alloys whose notable features are inertia and passivity. However, there are drawbacks to adapting material to an organism and the high probability of rejection. The third generation (in the 1990s) was based on the principle that the body does not have to adapt itself to the material, but that such material has to do so (Jacota, 2008). The term active biomaterial started to be used for identifying materials presenting similarities in composition or surface to that of a biological system, typical examples being calcium phosphates, hydroxyapatite and bio-glass (Jacota, 2008; Zárate and Reyes, 2006). The fourth generation was characterised by the fact that its object was to obtain materials interacting in-depth with biological systems by regulating a particular biological process, becoming integrated into the body and being degradable and which were able to fight against infection. They were designated smart materials due to their properties which were adapted to external stimuli, or in which functions and interaction with biological systems could be controlled by sensors (Jacota, 2008).
Designing and studying materials to be used for implants must consider that introducing a foreign element inside a alive organism is an event that leads to an interface between implant material and tissue where an interaction and a sequence of effects take place due to surface tension, free surface energy, electrical properties, material hydrophilicity and the presence of ion groups. Such interaction also concerns susceptibility to microbiological contamination of the material due to its surface (Barcellos et al., 1998). An important segment in orthopaedic material research has thus been addressed for evaluating biocompatibility aspects or the lack of some event regarding an adverse biological reaction (Alcaide et al., 2009).
Biodegradability can be considered as a process which must happen at a speed allowing tissue healing, so it is appropriate to consider that an appropriate material must allow progressive load transfer to the bone being healed simultaneously with the formation of new tissue, meaning that it has to be able to perform having properties related to osteoinductive, osteoregenerator and osteoconductive material (Pariente et al., 2006). Physical properties are another essential parameter when designing these materials since they must have good mechanical resistance, adequate fatigue strength and appropriate density and weight. Likewise, they have to be antiseptic or sterilisable and easily repro ducible for large-scale processing at the lowest possible cost (Navarro, 2005). Applying the material usually determines the physical properties to be controlled, as in the case of ceramic and injectable polymeric materials used in non-invasive surgical techniques in osteoarticular tissue involving rheological characterisation (Fatimi, 2009). This issue leads to considering the rheological behaviour characteristic of biological tissues, where it must be recognised that modelling these properties in live tissue results from the cells' microscopic properties, such study being difficult to carry out (C. Verdier, 2003).
Likewise, regardless of the material's chemical nature, implant structure and shape have a marked influence (Kong et al., 2007; Likibi et al., 2005), making porosity and topography decisive factors in facilitating joining bone (Davies, 2007; Kong et al., 2007; Likibi et al., 2005; Navarro, 2005).
Bioabsorbable materials were developed to avoid the need for a second surgical intervention for removing an implant. This is why they have to have adequate rigidity for bone to start healing, keeping its mechanical properties while forming bone callus, followed by their degradation (Ambard et al., 2005; Bordenave and Baquey, 2004; Navarro, 2005). Figure 1 summarises the main aspects considered in biodegradable material design for orthopaedic applications.
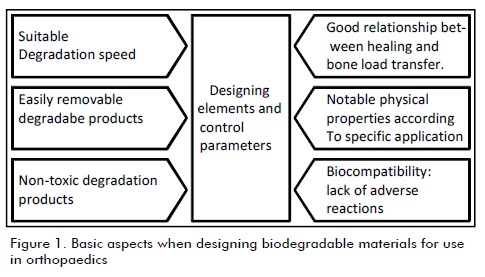
Degradable biomaterials
Natural and synthetic polymers, ceramics and biological glass and some metals and alloys have been most used in bone regeneration (Navarro, 2005; Tharanathan, 2003). Some notable aspects are introduced below for each of them (excluding metallic materials because they are not considered as biodegradable).
Natural and synthetic polymers
Concerns about sustainable development have led to boosting the study of biopolymer-based materials obtained by chemical synthesis or as a product of live organism metabolism (Bordes et al.,2009) which is why biopolymers are used in designing biomedical devices (Martins et al., 2008; Pashkuleva et al., 2007, Pavithra and Doble, 2008; Rojas et al., 2008). Although synthetic polymers offer advantages over natural derivatives since they can be designed according to the required properties (Armelin, 2002; Middleton and Tipton, 2000; Thombre and Sarwade, 2005), natural polymers cover an important segment of research due to advantages such as biocompatibility, being easily obtained, their low cost and the feasibility of chemically modifying them (Martins et al., 2008; Vaz et al., 2003). It is worthwhile mentioning the number of studies regarding incorporating natural polymers into synthetic polymers for improving their degradability and biocompatibility (Armelin, 2002). Some natural and synthetic biopolymers having potential application in implants are mentioned below.
Polysaccharides: Starches, lignocellulosic products (wood), pectins and gums come within this category. Starch, for instance is a low-cost, highly hydrophilic polymer which is easily available and can be used as a biodegradable additive (Martins et al., 2008; Pashkuleva, et al., 2007). Cellulose is the most naturally occurring polymer which is why it has been the subject of wide research as a potential biodegradable material when modifications are made to change its structure (Metabolix, 2009).
Lipids and proteins: Casein, collagen and serum are obtained from animal sources and gluten, soy and zein from vegetable sources.
Microbial polyesters or polyhydroxyalkanoates (PHA): These are produced by some microorganisms, having 30% to 80% of their dry cell weight. Polyhydroxybutyrate (PHB) is this family’s main homopolymer; it is highly crystalline and presents a wide processing window. Poly hydroxybutyrate-co-hydroxyvalerate (PHBV), poly hydroxybutyrate-co-hydroxyhexanoate (PHBHx), poly hydroxybutyrate-co-hydroxyoctanoate (PHBO) and poly hydroxybutyrate-co-hydroxyoctadecanoate (PHBOd) are widely used in medicine due to their biocompatibility (Maia et al., 2004). Copolymer properties vary according to their hydroxyvalerate (HV) content; when this is higher, there is increased resistance to impact and a drop in melting and glass transition temperatures occurs (Bordes et al., 2009).
Lactic acid polyesters: Lactic acid is a quiral molecule which has two stereoisomeric forms: L and D. It is obtained by chemical synthesis from several raw materials or through biological processes, L stereoisomer being the most abundant biological monomer (Pan and Inoue, 2009; Anderson and Shive, 1997; Ambrose and Clanton, 2004). Polymerisation of lactic acid by esterification leads to low molecular weight polymers which have several applications in the pharmaceutical field; however, they are not used in implants due to their poor mechanical properties. To obtain high molecular weight PLA typically it is used the intermediate product called lactide. Lactide becomes polymerised by a ring-opening mechanism generating high molecular weight polymers. PLA mechanical properties and biodegradation can be manipulated by D and L unit content in the polymer (Bordes et al., 2009). The homopolymer derived from l-lactic acid is useful in orthopaedic applications due to its high crystallinity, high tensile strength, low elongation and high modulus; it is frequently used for cell culture, tissue regeneration and orthopaedic implants and in tissue engineering due to its non-toxic properties and good compatibility (Santos and Rodríguez, 2009).
PLLA has also been used as copolymer with other synthetic and natural polymers (Shum et al., 2005; Mano et al., 2008). Polymer units D and L, being amorphous, have low tensile strength, high elongation and high degradation rate (Armelin, 2002). In studies involving fasteners such as rods, wires and screws made of lactic acid-derived polymers for treating fractures it has been reported that a high percentage of cases had no complications and that these are advantageous because a second surgery is not necessary (Rokkanen et al., 2000).
Polycaprolactone (PCL): This is obtained by polymerising ε-caprolactone in the presence of metal alkoxides, it is biodegradable and semi-crystalline (Bordes et al., 2009; Peña et al., 2006). PCL is widely used in biodegradable sutures; for increasing its rate of degradation, it is combined with D and L-lactic acid copolymers (Metabolix, 2009). It is not frequently used due to its low vitreous transition and low melting point but its advantage lies in its easy degradation by enzymatic mechanism.
Other synthetic polymers having biodegradation properties would include aliphatic polyesters, aromatic copolyesters and polyesteramides (Armelin, 2002).
Ceramic materials
There is great interest in using these materials for bone regeneration ( Martínez et al., 2008) due to their potential bioactivity based on their structural similarity with bone mineral phase and suitable biochemical reaction produced by interphase ceramicbone. The apatites, and more specifically hydroxyapatite, though being highly brittle, have good physical properties such as good temperature resistance, corrosion resistance, wear resistance and high hardness. Aluminium oxide and zirconia, called bio-inert ceramics (Jacota, 2008), have broad application in orthopaedics because of their high wear resistance; they are used in bone articulation implants, bone cement for filling small defects, reabsorbable materials for stimulating bone regeneration and metallic covered implants (Navarro, 2005). Biodegradable ceramics can be classified into calcium ceramics and bioglass.
Calcium phosphate ceramics (hydroxyapatites). These are good materials for use in bone system implants because of their goodm histological and in vivo performance (Pereda, 2005), associated with some factors such as calcium/phosphorus ratio (Ca/P), crystallographic structure and porosity. Regarding their application, several phases can be used; stability is highly influenced by temperature and water content. It should be pointed out that shape and particle size are important characteristics regarding the biological reaction of hydroxyapatite implants and that their tension, compression strength and wear strength depend on a particular material's porosity. They are used in granules for small implants which do not have to withstand great stress, as in the case of medium ear implants, porous material for stimulating bone growth or in cement that can be implanted in a viscous state and which settles in vivo (Fernández, 2005; Laquerriere et al., 2005).
Bioglass: These are amorphous materials whose vitreous structure is produced by linking several tetrahedrons from a specific ionic group forming a non-reticular crystal structure, meaning that they do not have periodicity inside their crystal structure. Among the four oxides producing classic glasses proposed by Zachariesen (SiO2, GeO2, B2O3 and P2O5), the most known oxides able to form a crystal structure are silicon oxide (SiO2) and phosphorus pentoxide (P2O5). This leads to SiO2-based and P2O5-based glasses. They are characterised by being haemocompatible by their ability to become adapted to bone’s mineral phase composition and by possible modifications which may be made to their degradation speed by changing their chemical composition. Their clinical applications include their use in releasing antibacterial ions (copper and silver) and in dentistry for fluor release (Navarro, 2005).
Hybrid or composite materials
A broad spectrum of chemical structures can be obtained by polymer chemical handling and the use of technical processing (i.e. electrospinning). Applying bioactive material surface treatments or nanoparticles can lead to obtaining nanocomposites having improved mechanical properties making the material more suitable for the body and thus replacing materials used at the present time (Fundación OPTI, 2008, Chen et al., 2010). Because biodegradable polyesters approved for human use by the Food and Drug Administration (FDA) degrade by autocatalysis and easily lose their mechanical properties, then materials have been proposed having a slower rate of degradation, polymer choice and developing organic-inorganic hybrid nanomaterials involving sol-gel synthesised ceramics or bioactive glasses being a key aspect in providing the material with excellent biological properties (Baino and Vitale-Brovarone, 2011; Valliant and Jones, 2011).
Inorganic / clay reinforced polymer nanocomposites
Polymers can be reinforced by dispersing in them inorganic compounds, as a way of combining advantages related to the polymer matrix process and advantages related to fillers, for example high modulus, good resistance to high temperatures and oxidation resistance (Wu and Mather, 2009). Clays normally used for manufacturing polymer nanocomposites can be classified according to their morphology; the most used are montmorillonite and saponite. Clay particle size and particle size ratio modify polymers' properties producing nanobiocomposites, these being materials having good biodegradability (Li et al., 2008). A broad variety of materials can thus be obtained, including organomodified layered silicate (OMLS) based on different biopolymers, different clays and using organocompounds via several synthesis methods, this being a way for improving some individual materials' properties (Bordes et al., 2009).
Surface treatment
Surface coatings represent an important tool in the biomaterial field for implants used for modifying bone surface (Goto, 2005) so that topography becomes changed, such as polymer composition and its ability to absorb water and ability to bind to osteoblast is promoted by mineral matrix formation (Advincula et al., 2006; Chai and Ben-Nissan, 1999; Pavithra and Doble, 2008). The low temperature required, high coating adherence (Lu et al., 2007) and thermal spraying methods (Gaona, 2007) justify sol–gel use. Because not all types of treatment are suitable for bone implant biomaterial, the most useful treatments are presented below.
Physicochemical treatment: These offer surface protection or activation. Such methods would include physical vapour deposition (PVD), chemical vapour deposition (CVD), ion implantation, sputtering, pulsed deposition, laser ablation and pulverised ion exchange.
Chemical treatment: These modify the initial material’s surface chemical composition; acid / basic treatment and electrochemical treatment are included in this group. The sol-gel procedure used for ceramic layer coating synthesis for covering biomaterials’ surface (i.e. titanium or modified titanium) fit into this group. Precursor selection and gel formation variations lead to controlling composition, structure and homogeneity of biologically interesting coatings such as titanium oxide, bioglass and calcium phosphate (Chai and Ben-Nissan, 1999; Jacota, 2008; Uhlmann et al., 1997). It is a good procedure for improving structures’ biocompatibility and avoiding metallic implant corrosion. Organic modified silanes (ORMOSILS) obtained by these techniques produce bioactive materials for bone replacement, a field where research has been focused on trying to improve substrate-coating layer integration (Gupta and Kumar, 2008; Schottner, 2001; Zarzycki, 1997).
Biological treatment: A material’s surface can be functionalised to bind to active molecules which are able to control cellular adhesion and at the same time induce a cellular response by immobilising peptides, proteins or growth factors.
Materials having biological reaction
Biomolecules have been incorporated into several materials’ scaffolds for optimising chemical, physical and biological properties for biomedical applications or for biologically activating these surfaces (Akkouch, 2008). Two trends may be identified in such development of bioactive, bioabsorbable materials, some stimulating molecular and cellular responses in a controlled way, others acting as temporal supports regarding bone defects in bone renewal (Yoshida et al., 2006). The former consists of developing tridimensional scaffolds without cells which could act as support for and house cells once implanted in vivo and the latter initially colonise scaffolds through progenitor cell in vitro conditions for being implanted and replacing damaged tissue (Navarro, 2005).
Conclusions
Regenerative medicine demands a wide range of approaches for changing the way of confronting illness by treatment, i.e. those related to the skeletal-muscle system. Although studies in this field of medicine explore potential regeneration of adult stem cells, another objective involving nanotechnology has focused on offering tissue engineering-related therapies involving the use of absorbable polymer materials and materials emulating different types of extra-cellular matrix present in tissues and the use of scaffolds that (once implanted) can be reabsorbed and renew injured tissue by new tissue having new vascularisation and nerve connections.
Due to the required materials' properties being defined regarding their specific application and the nature of interactions between an implant and the adjacent tissue, disregarding such interaction could develop adverse body reactions leading to rejection of the implant, which is why developing, designing and characterising such materials must involve physical and chemical characterisation, such biological evaluation leading to approaching their bioabsorbability, bioactivity and biocompatibility properties.
Using composites is a promising option in producing biodegradable materials for bone regeneration, involving selecting the polymer and incorporating active components at a molecular level where porous structure allows cell development and nutrient transmission. There is still a long way to go because no scaffolds have been reported to date having a good relationship between structural and mechanical properties that could simulate trabecular or cortical bone. Natural and synthetic biodegradables polymers are thus an interesting option due to their biocompatibility and the possibility of being metabolised once bone tissue has been regenerated; combined with ceramic materials, such as bioglass and hydroxyapatite, they present properties reinforcing bone regeneration. These properties have led to studying hybrids or composite materials because the involved materials’ individual properties can be improved, either through modifications or applying chemistry and physics to materials’ engineering.
Considerations to be taken into account in the evolution of new materials for biodegradable implants can be summarises as follows: the inevitable control of the cell/cell, cell/protein and protein/ surface interactions and a combination of specific properties of individual components contributing towards the development of new materials leading to the development of individual components’ optimised behaviour and the optimisation of their end behaviour.
References
Advincula, M., Rahemtulla, F., Advincula R., Ada E., Lemons J., Bellis S., Osteoblast adhesion and matrix mineralization on sol-gel-derived titanium oxide., Biomaterials, Vol. 27, No 10, 2006, pp. 2201-2212.
Akkouch, A., Incorporation de Fibronectine et d'albumine de sérum bovin à un biopolyère composé de Polypyrrole et de Poly (l-acide lactique) pour promouvoir la régénération tissulaire., tesis presentada a la Universidad de Laval, para optar el grado de Maestro en Ciencias en Medicina Experimental, 2008.
Alcaide, M., Serrano, M., Pagani, R., Sanchez, S., Vallet, M., Portoles, M., Biocompatibility markers for the study of interactions between osteoblasts and composite biomaterials., Biomaterials, Vol. 30, No 1, 2009, pp. 45-51.
Ambard, D., Le-Lez, S., Pedrono, A., Swider, P., Un modèle de prévision de cicatrisation de l’interface os-implant., ITBMRBM, Vol. 26, No 1, 2005, pp. 117-126.
Ambrose, C., Clanton, T., Bioabsorbable Implants: Review of Clinical Experience in Orthopedic Surgery Department of Orthopedic Surgery., Annals of Biomedical Engineering, Vol. 32, No 1, 2004, pp. 171-177.
Anderson, J., Shive, M., Biodegradation and biocompatibility of PLA and PLGA microspheres., Advanced Drug Delivery Reviews, Vol. 28, No 1, 1997, pp. 5-24.
Armelin, E., Síntesis y Caracterización de nuevas poliesteramidas: Estudio de sus propiedades., tesis presentada a la Universi- Universidad Politécnica de Cataluña, para optar el grado de Doctor en Ciencias, 2002.
Baino, F., Vitale-Brovarone, C., Three-dimensional glass derived scaffolds for bone tissue engineering: Currents trends and forecast for the future., Journal of Biomedical Materials Research A, Vol. 97A, No 4, 2011.
Barcellos, I., Carobrez, S., Pires, A., Alvarez, M., In vivo and in vitro responses to poly (ethylene terephthalate-co-diethylene glycol terephthalate) and polyethylene oxide blends., Biomaterials, Vol. 19, No 22, 1998, pp. 2075-2082.
Bordenave, L., Baquey, C., Médecine nucléaire et prothèses., Médecine Nucléaire - Imagerie fonctionnelle et métabolique, Vol. 28, No 12, 2004, pp 623-630.
Bordes, P., Pollet, E., Avérous, L., Nano-biocomposites: Biodegradable polyester/nanoclay systems., Progress in Polymer Science, Vol. 34, 2009, pp. 125-155.
Carvajal, M., Las caídas y fracturas de cadera en el adulto mayor., Revista Medica de Costa Rica y Centroamérica, Vol. LXIV, No 581, 2007, pp. 199-202.
Chai, C., Ben-Nissan, B., Bioactive nanocrystalline sol-gel hydroxyapatite coatings., Journal of Materials Science: Materials in Medicine, Vol. 10, No 8, 1999, pp. 465-469.
Chen, S., Osaka, A., Hayakawa, S., Shirosaki, Y., Tsuru, K., Morphology and structure of organosilica hybrid particles derived from tetramethoxysilane and viniltrimetoxisilane via catalyst-free sol-gel route., Journal of Materials Chemistry, Vol. 20, 2010, pp. 7337-7339.
Davies J., Bone bonding at natural and biomaterial surfaces., Biomaterials, Vol. 28, No 34, 2007, pp. 5058-5067.
Fatimi, A., Comportement rhéologique de biomatériaux pour l’ingénierie ostéoarticulaire et dentaire: matrices extracellulaires synthétiques et suspensions phosphocalciques., IRBM, Vol. 30, No 3, 2009, pp. 139 -140.
Fernández, E., Obtención y caracterización de nuevos cementos óseos de fosfatos de calcio en el sistema CaHPO4-Ca3 (PO4)2., tesis presentada a la Universidad Politécnica de Cataluña, para optar el grado de Doctor en Ciencias de los Materiales, 2005.
Fundación OPTI., Ministerio de Industria, Turismo y Comercio, Gobierno de España, Observatorio de Prospectiva Tecnológica Industrial, Aplicaciones Industriales de las Nanotecnologías en España en el Horizonte 2020., España, 2008. On line at http://www.navarrainnova.com/pdf/2009/ nanoindustrial2020OPTI.pdf, Consultado Julio 2011.
Gaona, M., Recubrimientos biocompatibles obtenidos por Proyección Térmica y estudio in vitro de la función osteoblástica., tesis presentada a la Universidad de Barcelona para optar el grado de Doctor en Ciencias Químicas, 2007.
Goto, T., Surface coating technology for biomaterials- morphology and nanostructure., Control International Congress Series, Vol. 1284, 2005, pp 248-256.
Gupta, R., Kumar, A., Bioactive materials for biomedical applications using sol-gel technology., Biomedical Materials, Vol. 3, No. 3, 2008, pp1-15.
Jacota, S., Films Minces de Dioxyde de Titane Déposés sur Titane par MOCVD: Microstructure et Biocompatibilité., tesis presentada a la Universidad de Toulouse, para optar el grado de Doctor en Ciencia e Ingeniería de Materiales, 2008.
Kong, L., Ao, Q., Wang, A., Gong, K., Wang, X., Lu, G., Gong, Y., Zhao, N., Zhang, X., Preparation and Characterization of a Multilayer Biomimetic Scaffold for Bone Tissue Engineering., Journal of Biomaterials Applications, Vol. 22, No. 3,2007, pp 223-239.
Laquerriere, P., Grandjean-Laquerriere, A., Jallot, E., Nardin, M., Frayssinet, P., Nedelec, J.M., Laurent-maquin, D., Influence des propriétés physico-chimiques d'hydroxyapatites sur le comportement cellulaire., Revue Européenne de Technologie Biomédicale, Vol. 26, No 3, 2005, pp. 200-205.
Li, H., Zhai, W., Chang, J., Effects of Wollastonite on Proliferation and Differentiation of Human Bone Marrow-derived Stromal Cells in PHBV/Wollastonite Composite Scaffolds., Jounal of Biomaterials Applications, Vol. 00, 2008, pp. 1- 16.
Likibi, F., Assad, M., Coillard, C., Chabot, G., Rivard, C., Intégration et apposition osseuses des biomatériaux orthopédiques métalliques poreux et non poreux., Annales de chirurgie, Vol. 130, No 4, 2005, pp. 235-241.
Lu, X., Wang, Y., Liu, Y., Wang J., Qu S., Feng, B., Weng J., Preparation of HA/chitosan composite coatings on alkali treated titanium surfaces through sol-gel techniques, Materials Letters, Vol. 61, No. 18, 2007, pp. 3970-3973.
Maia, J., Santana, M., Re, M., The effect of some processing conditions on the characteristics of biodegradable microspheres obtained by an emulsion solvent evaporation process, Braz., Journal of Chemical and Engineering, Vol. 21, No. 1, 2004, pp. 1-12.
Mano, J. F., Hungerford G., Gomez, J.L., Bioactive Poly (L-Lactic Acid)-Chitosan Hybrid Scaffolds., Materials Science and Engineering C, Vol. 28, No 8, 2008, pp. 1356-1365.
Martínez, A., Esparza, H., Carvajal, G., Ortiz, J., Caracterización estructural y morfológica de hidroxiapatita nanoestructurada: estudio comparativo de diferentes métodos de síntesis., Superficies y Vacío, Vol. 21, No 4, 2008, pp. 18-21.
Natural origin scaffolds with in situ pore forming capability for bone tissue engineering applications., Acta Biomaterialia, Vol. 4, No 6, 2008, pp. 1637-1645.
Metabolix Bioindustries Evolution., Bioplásticos. On line at http://www.metabolix.com, Consultado Nov. 2009.
Middleton, J., Tipton, A., Synthetic biodegradable polymers as orthopedic devices., Biomaterials, Vol. 21, 2000, pp. 2335- 2346.
Navarro, M., Desarrollo y caracterización de materiales biodegradables para regeneración ósea., tesis presentada a la Universidad Politécnica de Cataluña para optar el grado de Doctor en Ciencias, 2005.
Pan, P., Inoue, Y., Polymorphism and isomorphism in biodegradable polyesters., Progress in Polymer Science, Vol. 34, No 7, 2009, pp. 605-640.
Pariente, J., Bordenave, L., Villars, F., Renard, M., Delmond, S., ricain, J., Baquey, C., Centre d'innovations technologiques biomatériaux du CHU de Bordeaux., ITBM-RBM, Vol. 27, No 4, 2006, pp. 150-155.
Pashkuleva, I., Azevedo, H., Reis, R., Surface Structural Investigation of Starch-Based, Macromol. Biosci., Vol. 8, No. 2, 2007, pp. 210-219.
Pavithra, D., Doble, M., Biofilm formation, bacterial adhesion and host response on polymeric implants-issues and prevention., Biomed. Mater. Vol. 3, No 3, 2008, pp. 1-13.
Peña, J., Corrales, T., Izquierdo, I., Doadrio, A., Vallet, M., Long term degradation of poly(3-caprolactone) films in biologically related fluids., Polymer Degradation and Stability, Vol. 91, No 7, 2006, pp. 1424 -1432.
Pereda, O., Metodología de empleo de la hidroxiapatita coralina HAP-200 en Ortopedia y Traumatología., Rev. Cubana Ortop. Traumatol., Vol 19, No 1, 2005, pp. 35-40.
Rodriguez Santos Jr, A., Analysis of the Growth Pattern of Vero Cells Cultured on Dense and Porous Poly (L-Lactic Acid) Scaffolds., Materials Research, Vol. 12, No 3, 2009 pp. 257-263.
Rojas, M., Vallejo, B., Perilla, J. E., Los biopolímeros como materiales para el desarrollo de productos en aplicaciones farmacéuticas y de uso biomédico, Ingeniería e Investigación, Vol. 28, No 1, 2008, pp. 57-71.
Rokkanen, P., Böstman, O., Hirvensalo, E., Makela, E., Partio, E., Patiala, H., Vainionpaa, S., Vihtonen, K., Tormala, P., Bioabsorbable fixation in orthopaedic surgery and traumatology., Biomaterials, Vol. 21, No 24, 2000, pp.2607-2613.
Schottner, G., Hybrid Sol-Gel-Derived Polymers: Applications of Multifunctional Materials., Chemistry of Materials, Vol. 13, No 10, 2001, pp. 3422-3435.
Shum, A. W. T., Li, J., Mak A. F. T., Fabrication and Structural Characterization of Porous Biodegradable Poly(DL-Lactic-Co-Glycolic Acid) Scaffolds with Controlled Range of Pore Sizes., Polymer Degradation and Stability, Vol. 87, No. 3, 2005, pp.487-493.
Tharanathan, R., Biodegradable films and composite coatings: past, present and future., Trends in Food Science & Technology, Vol. 14, No 3, 2003, pp. 71-78.
The Bone and Joint Decade 2000-2010., Report 2009. On line at http://www.boneandjointdecade.org/HTML/musconline/images/BJD%20annual%20report%202009.pdf, Consultado Julio 2011.
Thombre, S., Sarwade, B., Synthesis and Biodegradability of Polyaspartic Acid: A Critical Review, Journal of Macromolecular Science., Part A: Pure and Applied Chemistry, Vol. 42, No. 9, 2005, pp. 1299-1315.
Uhlmann, D., Teowee, G., Boulton, J., The Future of Sol-Gel Science and Technology., Journal of Sol-Gel Science and Technology, Vol. 8, No 1-3, 1997, pp. 1083-1091.
United Nations, Department of Economic and Social Affairs, World Population Prospects., Revision: Analytical Report, 2004. On line at http://www.un.org/esa/population/publications/WPP2004/2004Highlights_finalrevised.pdf, Consultado Julio 2011.
Valliant, E., Jones, J., Softening bioactive glass for bone regenerative sol-gel hybrid materials., Soft Matter, Vol. 7, 2011, pp. 5083-5095.
Vaz, C., de Graaf, L., Reis, R., Cunha, A., In vitro degradation behavior of biodegradable soy plastics: effects of crosslinking with glyoxal and thermal treatment., Polymer Degradation and Stability, Vol. 81, 2003, pp. 65-74.
Verdier, C., Rheological Properties of Living Materials. From Cells to Tissues., Journal of Theoretical Medicine, Vol. 5, No 2, 2003, pp. 67-91.
Wu, J., Mather, P., POSS Polymers: Physical Properties and Biomaterials Applications., Polymer Reviews, Vol. 49, No 1, 2009, pp. 25-63.
Yoshida, M., Langer, R., Lendlein, A., Lahann, J., From Advanced Biomedical Coatings to Multi-Functionalized Biomaterials., Polymer Reviews, Vol. 46, No 4, 2006, pp. 347- 375.
Zárate, B., Reyes, A., Injertos óseos en cirugía ortopédica., Cirugía y Cirujanos, Vol. 74, No 3, 2006, pp. 217- 222.
Zarzycki, J., Past and Present of Sol-Gel Science and Technology., Journal of Sol-Gel Science and Technology, Vol. 8, No. 1-3, 1997, pp. 17-22.
References
Advincula, M., Rahemtulla, F., Advincula R., Ada E., Lemons J., Bellis S., Osteoblast adhesion and matrix mineralization on sol-gel-derived titanium oxide., Biomaterials, Vol. 27, No 10, 2006, pp. 2201-2212. DOI: https://doi.org/10.1016/j.biomaterials.2005.11.014
Akkouch, A., Incorporation de Fibronectine et d'albumine de sérum bovin à un biopolyère composé de Polypyrrole et de Poly (l-acide lactique) pour promouvoir la régénération tissulaire., tesis presentada a la Universidad de Laval, para optar el grado de Maestro en Ciencias en Medicina Experimental, 2008.
Alcaide, M., Serrano, M., Pagani, R., Sanchez, S., Vallet, M., Portoles, M., Biocompatibility markers for the study of interactions between osteoblasts and composite biomaterials., Biomaterials, Vol. 30, No 1, 2009, pp. 45-51. DOI: https://doi.org/10.1016/j.biomaterials.2008.09.012
Ambard, D., Le-Lez, S., Pedrono, A., Swider, P., Un modèle de prévision de cicatrisation de l’interface os-implant., ITBMRBM, Vol. 26, No 1, 2005, pp. 117-126. DOI: https://doi.org/10.1016/j.rbmret.2004.12.002
Ambrose, C., Clanton, T., Bioabsorbable Implants: Review of Clinical Experience in Orthopedic Surgery Department of Orthopedic Surgery., Annals of Biomedical Engineering, Vol. 32, No 1, 2004, pp. 171-177. DOI: https://doi.org/10.1023/B:ABME.0000007802.59936.fc
Anderson, J., Shive, M., Biodegradation and biocompatibility of PLA and PLGA microspheres., Advanced Drug Delivery Reviews, Vol. 28, No 1, 1997, pp. 5-24. DOI: https://doi.org/10.1016/S0169-409X(97)00048-3
Armelin, E., Síntesis y Caracterización de nuevas poliesteramidas: Estudio de sus propiedades., tesis presentada a la Universidad Politécnica de Cataluña, para optar el grado de Doctor en Ciencias, 2002.
Baino, F., Vitale-Brovarone, C., Three-dimensional glass derived scaffolds for bone tissue engineering: Currents trends and forecast for the future., Journal of Biomedical Materials Research A, Vol. 97A, No 4, 2011. DOI: https://doi.org/10.1002/jbm.a.33072
Barcellos, I., Carobrez, S., Pires, A., Alvarez, M., In vivo and in vitro responses to poly (ethylene terephthalate-co-diethylene glycol terephthalate) and polyethylene oxide blends., Biomaterials, Vol. 19, No 22, 1998, pp. 2075-2082. DOI: https://doi.org/10.1016/S0142-9612(98)00119-7
Bordenave, L., Baquey, C., Médecine nucléaire et prothèses., Médecine Nucléaire - Imagerie fonctionnelle et métabolique, Vol. 28, No 12, 2004, pp 623-630.
Bordes, P., Pollet, E., Avérous, L., Nano-biocomposites: Biodegradable polyester/nanoclay systems., Progress in Polymer Science, Vol. 34, 2009, pp. 125-155. DOI: https://doi.org/10.1016/j.progpolymsci.2008.10.002
Carvajal, M., Las caídas y fracturas de cadera en el adulto mayor., Revista Medica de Costa Rica y Centroamérica, Vol. LXIV, No 581, 2007, pp. 199-202.
Chai, C., Ben-Nissan, B., Bioactive nanocrystalline sol-gel hydroxyapatite coatings., Journal of Materials Science: Materials in Medicine, Vol. 10, No 8, 1999, pp. 465-469. DOI: https://doi.org/10.1023/A:1008992807888
Chen, S., Osaka, A., Hayakawa, S., Shirosaki, Y., Tsuru, K., Morphology and structure of organosilica hybrid particles derived from tetramethoxysilane and viniltrimetoxisilane via catalyst-free sol-gel route., Journal of Materials Chemistry, Vol. 20, 2010, pp. 7337-7339. DOI: https://doi.org/10.1039/c0jm01546f
Davies J., Bone bonding at natural and biomaterial surfaces., Biomaterials, Vol. 28, No 34, 2007, pp. 5058-5067. DOI: https://doi.org/10.1016/j.biomaterials.2007.07.049
Fatimi, A., Comportement rhéologique de biomatériaux pour l’ingénierie ostéoarticulaire et dentaire: matrices extracellulaires synthétiques et suspensions phosphocalciques., IRBM, Vol. 30, No 3, 2009, pp. 139 -140. DOI: https://doi.org/10.1016/j.irbm.2008.11.001
Fernández, E., Obtención y caracterización de nuevos cementos óseos de fosfatos de calcio en el sistema CaHPO4-Ca3 (PO4)2., tesis presentada a la Universidad Politécnica de Cataluña, para optar el grado de Doctor en Ciencias de los Materiales, 2005.
Fundación OPTI., Ministerio de Industria, Turismo y Comercio, Gobierno de España, Observatorio de Prospectiva Tecnológica Industrial, Aplicaciones Industriales de las Nanotecnologías en España en el Horizonte 2020., España, 2008. On line at http://www.navarrainnova.com/pdf/2009/nanoindustrial2020OPTI.pdf, Consultado Julio 2011.
Gaona, M., Recubrimientos biocompatibles obtenidos por Proyección Térmica y estudio in vitro de la función osteoblástica., tesis presentada a la Universidad de Barcelona para optar el grado de Doctor en Ciencias Químicas, 2007.
Goto, T., Surface coating technology for biomaterials- morphology and nanostructure., Control International Congress Series, Vol. 1284, 2005, pp 248-256. DOI: https://doi.org/10.1016/j.ics.2005.06.007
Gupta, R., Kumar, A., Bioactive materials for biomedical applications using sol-gel technology., Biomedical Materials, Vol. 3, No. 3, 2008, pp.1-15. DOI: https://doi.org/10.1088/1748-6041/3/3/034005
Jacota, S., Films Minces de Dioxyde de Titane Déposés sur Titane par MOCVD: Microstructure et Biocompatibilité., tesis presentada a la Universidad de Toulouse, para optar el grado de Doctor en Ciencia e Ingeniería de Materiales, 2008.
Kong, L., Ao, Q., Wang, A., Gong, K., Wang, X., Lu, G., Gong, Y., Zhao, N., Zhang, X., Preparation and Characterization of a Multilayer Biomimetic Scaffold for Bone Tissue Engineering., Journal of Biomaterials Applications, Vol. 22, No. 3,2007, pp 223-239. DOI: https://doi.org/10.1177/0885328206073706
Laquerriere, P., Grandjean-Laquerriere, A., Jallot, E., Nardin, M., Frayssinet, P., Nedelec, J.M., Laurent-maquin, D., Influence des propriétés physico-chimiques d'hydroxyapatites sur le comportement cellulaire., Revue Européenne de Technologie Biomédicale, Vol. 26, No 3, 2005, pp. 200-205. DOI: https://doi.org/10.1016/j.rbmret.2005.04.007
Li, H., Zhai, W., Chang, J., Effects of Wollastonite on Proliferation and Differentiation of Human Bone Marrow-derived Stromal Cells in PHBV/Wollastonite Composite Scaffolds., Journal of Biomaterials Applications, Vol. 00, 2008, pp. 1- 16.
Likibi, F., Assad, M., Coillard, C., Chabot, G., Rivard, C., Intégration et apposition osseuses des biomatériaux orthopédiques métalliques poreux et non poreux., Annales de chirurgie, Vol. 130, No 4, 2005, pp. 235-241. DOI: https://doi.org/10.1016/j.anchir.2004.12.006
Lu, X., Wang, Y., Liu, Y., Wang J., Qu S., Feng, B., Weng J., Preparation of HA/chitosan composite coatings on alkali treated titanium surfaces through sol-gel techniques, Materials Letters, Vol. 61, No. 18, 2007, pp. 3970-3973. DOI: https://doi.org/10.1016/j.matlet.2006.12.089
Maia, J., Santana, M., Re, M., The effect of some processing conditions on the characteristics of biodegradable microspheres obtained by an emulsion solvent evaporation process, Braz., Journal of Chemical and Engineering, Vol. 21, No. 1, 2004, pp. 1-12. DOI: https://doi.org/10.1590/S0104-66322004000100002
Mano, J. F., Hungerford G., Gomez, J.L., Bioactive Poly (L-Lactic Acid)-Chitosan Hybrid Scaffolds., Materials Science and Engineering C, Vol. 28, No 8, 2008, pp. 1356-1365. DOI: https://doi.org/10.1016/j.msec.2008.03.005
Martínez, A., Esparza, H., Carvajal, G., Ortiz, J., Caracterización estructural y morfológica de hidroxiapatita nanoestructurada: estudio comparativo de diferentes métodos de síntesis., Superficies y Vacío, Vol. 21, No 4, 2008, pp. 18-21.
Natural origin scaffolds with in situ pore forming capability for bone tissue engineering applications., Acta Biomaterialia, Vol. 4, No 6, 2008, pp. 1637-1645. DOI: https://doi.org/10.1016/j.actbio.2008.06.004
Metabolix Bioindustries Evolution., Bioplásticos. On line at http://www.metabolix.com, Consultado Nov. 2009.
Middleton, J., Tipton, A., Synthetic biodegradable polymers as orthopedic devices., Biomaterials, Vol. 21, 2000, pp. 2335- 2346. DOI: https://doi.org/10.1016/S0142-9612(00)00101-0
Navarro, M., Desarrollo y caracterización de materiales biodegradables para regeneración ósea., tesis presentada a la Universidad Politécnica de Cataluña para optar el grado de Doctor en Ciencias, 2005.
Pan, P., Inoue, Y., Polymorphism and isomorphism in biodegradable polyesters., Progress in Polymer Science, Vol. 34, No 7, 2009, pp. 605-640. DOI: https://doi.org/10.1016/j.progpolymsci.2009.01.003
Pariente, J., Bordenave, L., Villars, F., Renard, M., Delmond, S., ricain, J., Baquey, C., Centre d'innovations technologiques biomatériaux du CHU de Bordeaux., ITBM-RBM, Vol. 27, No 4, 2006, pp. 150-155. DOI: https://doi.org/10.1016/j.rbmret.2006.07.007
Pashkuleva, I., Azevedo, H., Reis, R., Surface Structural Investigation of Starch-Based, Macromol. Biosci., Vol. 8, No. 2, 2007, pp. 210-219. DOI: https://doi.org/10.1002/mabi.200700076
Pavithra, D., Doble, M., Biofilm formation, bacterial adhesion and host response on polymeric implants-issues and prevention., Biomed. Mater. Vol. 3, No 3, 2008, pp. 1-13. DOI: https://doi.org/10.1088/1748-6041/3/3/034003
Peña, J., Corrales, T., Izquierdo, I., Doadrio, A., Vallet, M., Long term degradation of poly(3-caprolactone) films in biologically related fluids., Polymer Degradation and Stability, Vol. 91, No 7, 2006, pp. 1424 -1432. DOI: https://doi.org/10.1016/j.polymdegradstab.2005.10.016
Pereda, O., Metodología de empleo de la hidroxiapatita coralina HAP-200 en Ortopedia y Traumatología., Rev. Cubana Ortop. Traumatol., Vol 19, No 1, 2005, pp. 35-40.
Rodríguez Santos Jr, A., Analysis of the Growth Pattern of Vero Cells Cultured on Dense and Porous Poly (L-Lactic Acid) Scaffolds., Materials Research, Vol. 12, No 3, 2009 pp. 257-263. DOI: https://doi.org/10.1590/S1516-14392009000300002
Rojas, M., Vallejo, B., Perilla, J. E., Los biopolímeros como materiales para el desarrollo de productos en aplicaciones farmacéuticas y de uso biomédico, Ingeniería e Investigación, Vol. 28, No 1, 2008, pp. 57-71.
Rokkanen, P., Böstman, O., Hirvensalo, E., Makela, E., Partio, E., Patiala, H., Vainionpaa, S., Vihtonen, K., Tormala, P., Bioabsorbable fixation in orthopaedic surgery and traumatology., Biomaterials, Vol. 21, No 24, 2000, pp.2607-2613. DOI: https://doi.org/10.1016/S0142-9612(00)00128-9
Schottner, G., Hybrid Sol-Gel-Derived Polymers: Applications of Multifunctional Materials., Chemistry of Materials, Vol. 13, No 10, 2001, pp. 3422-3435. DOI: https://doi.org/10.1021/cm011060m
Shum, A. W. T., Li, J., Mak A. F. T., Fabrication and Structural Characterization of Porous Biodegradable Poly(DL-Lactic-Co-Glycolic Acid) Scaffolds with Controlled Range of Pore Sizes., Polymer Degradation and Stability, Vol. 87, No. 3, 2005, pp.487-493. DOI: https://doi.org/10.1016/j.polymdegradstab.2004.10.005
Tharanathan, R., Biodegradable films and composite coatings: past, present and future., Trends in Food Science & Technology, Vol. 14, No 3, 2003, pp. 71-78. DOI: https://doi.org/10.1016/S0924-2244(02)00280-7
The Bone and Joint Decade 2000-2010., Report 2009. On line at http://www.boneandjointdecade.org/HTML/musconline/images/BJD%20annual%20report%202009.pdf, Consultado Julio 2011.
Thombre, S., Sarwade, B., Synthesis and Biodegradability of Polyaspartic Acid: A Critical Review, Journal of Macromolecular Science., Part A: Pure and Applied Chemistry, Vol. 42, No. 9, 2005, pp. 1299-1315. DOI: https://doi.org/10.1080/10601320500189604
Uhlmann, D., Teowee, G., Boulton, J., The Future of Sol-Gel Science and Technology., Journal of Sol-Gel Science and Technology, Vol. 8, No 1-3, 1997, pp. 1083-1091. DOI: https://doi.org/10.1007/BF02436988
United Nations, Department of Economic and Social Affairs, World Population Prospects., Revision: Analytical Report, 2004. On line at http://www.un.org/esa/population/publications/WPP2004/2004Highlights_finalrevised.pdf, Consultado Julio 2011.
Valliant, E., Jones, J., Softening bioactive glass for bone regenerative sol-gel hybrid materials., Soft Matter, Vol. 7, 2011, pp. 5083-5095. DOI: https://doi.org/10.1039/c0sm01348j
Vaz, C., de Graaf, L., Reis, R., Cunha, A., In vitro degradation behavior of biodegradable soy plastics: effects of crosslinking with glyoxal and thermal treatment., Polymer Degradation and Stability, Vol. 81, 2003, pp. 65-74. DOI: https://doi.org/10.1016/S0141-3910(03)00063-6
Verdier, C., Rheological Properties of Living Materials. From Cells to Tissues., Journal of Theoretical Medicine, Vol. 5, No 2, 2003, pp. 67-91. DOI: https://doi.org/10.1080/10273360410001678083
Wu, J., Mather, P., POSS Polymers: Physical Properties and Biomaterials Applications., Polymer Reviews, Vol. 49, No 1, 2009, pp. 25-63. DOI: https://doi.org/10.1080/15583720802656237
Yoshida, M., Langer, R., Lendlein, A., Lahann, J., From Advanced Biomedical Coatings to Multi-Functionalized Biomaterials., Polymer Reviews, Vol. 46, No 4, 2006, pp. 347- 375. DOI: https://doi.org/10.1080/15583720600945394
Zárate, B., Reyes, A., Injertos óseos en cirugía ortopédica., Cirugía y Cirujanos, Vol. 74, No 3, 2006, pp. 217- 222.
Zarzycki, J., Past and Present of Sol-Gel Science and Technology., Journal of Sol-Gel Science and Technology, Vol. 8, No. 1-3, 1997, pp. 17-22. DOI: https://doi.org/10.1007/BF02436811
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
CrossRef Cited-by
1. Sara Poveda‐Reyes, Leonardo Rubén Mellera‐Oglialoro, Rebeca Martínez‐Haya, Tatiana Carolina Gamboa‐Martínez, Jose Luís Gómez Ribelles, Gloria Gallego Ferrer. (2015). Reinforcing an Injectable Gelatin Hydrogel with PLLA Microfibers: Two Routes for Short Fiber Production. Macromolecular Materials and Engineering, 300(10), p.977. https://doi.org/10.1002/mame.201500033.
2. Esperanza Díaz, Itsaso Ibáñez, Igor Puerto. (2016). Encyclopedia of Biomedical Polymers and Polymeric Biomaterials. , p.7016. https://doi.org/10.1081/E-EBPP-120049920.
3. Shantanu Bandopadhyay, Nabamita Bandyopadhyay, Sarfaraz Ahmed, Vivek Yadav, Rakesh K. Tekade. (2019). Biomaterials and Bionanotechnology. , p.337. https://doi.org/10.1016/B978-0-12-814427-5.00010-X.
4. Muahmmad Naveed Anjum, Shoaib Ahmad Malik, Choudhary Haseeb Bilal, Umer Rashid, Muhammad Nasif, Khalid Mahmood Zia. (2020). Bionanocomposites. , p.321. https://doi.org/10.1016/B978-0-12-816751-9.00013-1.
5. Rubén García-Sobrino, Marta Muñoz, Elías Rodríguez-Jara, Joaquín Rams, Belén Torres, Sandra C. Cifuentes. (2023). Bioabsorbable Composites Based on Polymeric Matrix (PLA and PCL) Reinforced with Magnesium (Mg) for Use in Bone Regeneration Therapy: Physicochemical Properties and Biological Evaluation. Polymers, 15(24), p.4667. https://doi.org/10.3390/polym15244667.
6. Vinay Mohan Pathak, Navneet. (2017). Review on the current status of polymer degradation: a microbial approach. Bioresources and Bioprocessing, 4(1) https://doi.org/10.1186/s40643-017-0145-9.
Dimensions
PlumX
Article abstract page views
Downloads
License
Copyright (c) 2011 Clara Eugenia Plazas Bonilla, Jairo Ernesto Perilla

This work is licensed under a Creative Commons Attribution 4.0 International License.
The authors or holders of the copyright for each article hereby confer exclusive, limited and free authorization on the Universidad Nacional de Colombia's journal Ingeniería e Investigación concerning the aforementioned article which, once it has been evaluated and approved, will be submitted for publication, in line with the following items:
1. The version which has been corrected according to the evaluators' suggestions will be remitted and it will be made clear whether the aforementioned article is an unedited document regarding which the rights to be authorized are held and total responsibility will be assumed by the authors for the content of the work being submitted to Ingeniería e Investigación, the Universidad Nacional de Colombia and third-parties;
2. The authorization conferred on the journal will come into force from the date on which it is included in the respective volume and issue of Ingeniería e Investigación in the Open Journal Systems and on the journal's main page (https://revistas.unal.edu.co/index.php/ingeinv), as well as in different databases and indices in which the publication is indexed;
3. The authors authorize the Universidad Nacional de Colombia's journal Ingeniería e Investigación to publish the document in whatever required format (printed, digital, electronic or whatsoever known or yet to be discovered form) and authorize Ingeniería e Investigación to include the work in any indices and/or search engines deemed necessary for promoting its diffusion;
4. The authors accept that such authorization is given free of charge and they, therefore, waive any right to receive remuneration from the publication, distribution, public communication and any use whatsoever referred to in the terms of this authorization.



























