Mecanismos moleculares por los cuales los ácidos grasos podrían influir en la captación de glucosa
Molecular mechanisms by which free fatty acids might interfere with periferic insuline action
Palabras clave:
ácidos grasos, diabetes mellitus, obesidad, insulina, glucosa, hiperglucemia, xilulosa, glucólisis. (es)fatty acids, diabetes mellitus, obesity, insulin, glucose, hyperglycemia, xylulose, glycolysis. (en)
Esta revisión tiene el propósito de actualizar el probable mecanismo molecular que ejercen los ácidos grasos en las células que captan glucosa, bajo el estimulo de la insulina y su posible implicación en la diabetes mellitus tipo 2 en la que suelen asociarse resistencia a la insulina, obesidad y síndrome metabólico.
Entre los mecanismos moleculares por los cuales un aumento de los ácidos grasos libres podría producir resistencia a la insulina, se encuentra la disminución de los niveles de xilulosa 5-fosfato que bloquea la glucólisis por inhibición de la fosfofructocinasa, ello conduce a un aumento de los productos finales en la vía de las hexosaminas y a la activación de la proteincinasa C, un conocido activador de inhibidor de la cinasa Kappa Beta que inhibe la fosforilación del receptor del sustrato de insulina en tirosina, bloqueando los transportadores de glucosa. Existen investigaciones que sugieren que los ácidos grasos libres están implicados en la insulino-resistencia pero el mecanismo bioquímico no esta dilucidado del todo, pues no hay un mecanismo integral que los relacione o interconecte para concluir determinantemente cómo los altos niveles de ácidos grasos libres inducen la resistencia a la insulina.
Previous research suggests that free fatty acids are implicated in insulin resistance, but the molecular mechanism for it isn't completely elucidated, given the lack of an integrated hypothesis relating all of the proposed mechanisms. At the present time, the causes of insulin resistance, obesity and metabolic syndrome, a common feature in patients with diabetes mellitus are matter of intense study.
Among several molecular mechanisms by which the increase in free fatty acids could raise insulin resistance is decrease in xylulose-5-phosphate that leads to an inhibition of phosphofructokinase-2, and consequently to a blockade in glycol sis with a subsequent increase in the final products of the hexosamine pathway and activation of PKC has been proposed as well as known activator of IKKB that inhibits tyrosine phosphorilation of IRS, hindering glucose transport.
ACTUALIZACIÓN
Clara Eugenia Pérez1, Carlos Arturo Guerrero2
1.Bacterióloga con entrenamiento en Diabetes Mellitus y Dislipidemia, Candidata a Magister en Bioquímica, División de Lípidos y Diabetes, Facultad de Medicina, Universidad Nacional de Colombia Bogotá.
2.Profesor Asociado, Coordinador Maestría en Bioquímica, MD MSc. PhD, Facultad de Medicina, Universidad Nacional de Colombia Bogotá
Correspondencia:ceperezg@unal.edu.co
Resumen
Esta revisión tiene el propósito de actualizar el probable mecanismo molecular que ejercen los ácidos grasos en las células que captan glucosa, bajo el estimulo de la insulina y su posible implicación en la diabetes mellitus tipo 2 en la que suelen asociarse resistencia a la insulina, obesidad y síndrome metabólico.
Entre los mecanismos moleculares por los cuales un aumento de los ácidos grasos libres podría producir resistencia a la insulina, se encuentra la disminución de los niveles de xilulosa 5-fosfato que bloquea la glucólisis por inhibición de la fosfofructocinasa, ello conduce a un aumento de los productos finales en la vía de las hexosaminas y a la activación de la proteincinasa C, un conocido activador de inhibidor de la cinasa Kappa Beta que inhibe la fosforilación del receptor del sustrato de insulina en tirosina, bloqueando los transportadores de glucosa. Existen investigaciones que sugieren que los ácidos grasos libres están implicados en la insulino-resistencia pero el mecanismo bioquímico no esta dilucidado del todo, pues no hay un mecanismo integral que los relacione o interconecte para concluir determinantemente cómo los altos niveles de ácidos grasos libres inducen la resistencia a la insulina.
Palabras clave: ácidos grasos, diabetes mellitus, obesidad, insulina, glucosa, hiperglucemia, xilulosa, glucólisis.
Summary
Previous research suggests that free fatty acids are implicated in insulin resistance, but the molecular mechanism for it isn't completely elucidated, given the lack of an integrated hypothesis relating all of the proposed mechanisms. At the present time, the causes of insulin resistance, obesity and metabolic syndrome, a common feature in patients with diabetes mellitus are matter of intense study.
Among several molecular mechanisms by which the increase in free fatty acids could raise insulin resistance is decrease in xylulose-5-phosphate that leads to an inhibition of phosphofructokinase-2, and consequently to a blockade in glycol sis with a subsequent increase in the final products of the hexosamine pathway and activation of PKC has been proposed as well as known activator of IKKB that inhibits tyrosine phosphorilation of IRS, hindering glucose transport.
Key words: fatty acids, diabetes mellitus, obesity, insulin, glucose, hyperglycemia, xylulose, glycolysis.
Introducción
Los tejidos muscular y adiposo captan glucosa mediante la acción de la insulina. Un aumento de la glucosa en sangre posterior a la ingesta de alimento (estado alimentario) estimula la secreción de insulina. La insulina actúa sobre sus células blanco, se une a su receptor y produce una cascada de eventos intracelulares que produce la traslocación de glucotransportadores a la superficie celular captando glucosa extracelular, a este proceso se le conoce como captación de glucosa estimulada por la insulina. En estado de ayuno los niveles de insulina decrecen, se produce aumento de hormonas contrarregulatorias, se activa la lipoprotein lipasa hormono-sensible, estimulando la obtención de energía a partir de sustratos no glúcidos, especialmente se aumenta la hidrólisis de triglicéridos de los adipocitos y se genera aumento de los ácidos grasos libres en circulación que son captados vía hepática para obtener energía, esto es lo que sucede en condiciones fisiológicas. El aumento de ácidos grasos puede influir en l a captación de glucosa estimulada por la insulina, a continuación se describen algunos mecanismos moleculares que explicarían este proceso (1-8).
Altos niveles de ácidos grasos inhiben la xilulosa 5-fosfato, bloqueando la glicólisis en el hígado
La xilulosa 5-fosfato es un intermediario en el metabolismo de las pentosas fosfato específicamente de la ribosa. Recientemente se descubrió que la xilulosa 5-fosfato está implicada en la activación de la fosfofructocinasa, enzima que regula la glicólisis. El ingreso de la glucosa a la célula activa la enzima bifuncional a través de la xilulosa 5-fosfato produciendo un incremento de fructosa 2,6-bifosfato, que es un potente activador de la fosfofructocinasa (9-11). Se ha sugerido que el aumento de los niveles plasmáticos de ácidos grasos (AG) bloquea la activación de la xilulosa 5-fosfato llevando al bloqueo de la glucólisis (12,13). Este mecanismo probablemente explique la hiperglucemia que aparece cuando hay un aumento de AG libres a nivel hepático inducida experimentalmente o por alteraciones del metabolismo lipídico. El bloqueo de la glicólisis pudiera generar señales conducentes a bloquear el ingreso de la glucosa a la célula, generando lo que se conoce como hiperglucemia secundaria a resistenci a la insulina (Figura 1). Es decir, altos niveles de AG libres (AGL) coexisten con altos niveles de insulina y a la vez altos niveles de glucosa en plasma que no ingresan a la célula. No se ha determinado a partir de que concentración de AGL se dispara este mecanismo.
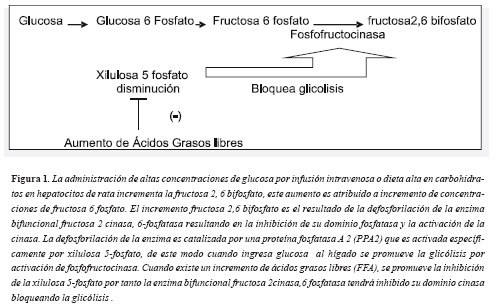
Experimentalmente se determinó el efecto de los ácidos grasos en el hígado de rata perfundidos e intactos sobre los niveles de la xilulosa 5-fosfato. Para dilucidar el mecanismo por el cual los AG inhibían la utilización de glucosa en el hígado se perfundieron ratas durante 100 minutos con altas concentraciones de glucosa (10 nM), acetato (5mM), propionato (10mM) o butirato (5 mM), los tres últimos son ácidos grasos de cadena corta, con objeto de inducir hiperglicemia en presencia de altos niveles de AG. Posteriormente se extrajeron los hígados y se cuantificaron la
actividad de la enzima bifuncional (fructosa 6-fosfato, 2 cinasa y fructosa 2,6 bifosfatasa) implicada en la glicólisis y los intermediarios metabólicos de la glicólisis (xilulosa 5-fosfato, glucosa 6P, gliceraldehido 3P). Se encontró un aumento de la forma fosforilada de la enzima bifuncional permitiendo explicar el bloqueo de la glicólisis. Igualmente se halló disminución de los niveles de xilulosa 5-fosfato. Los bajos niveles de xilulosa 5-fosfato, activan la proteína fosfatasa (PPA2) esto aumentó la fosforilación de la enzima bifuncional y en consecuencia disminuyó la fructosa 2,6 P2 bloqueando la glicólisis. En resumen, los resultados sugieren que el aumento de los ácidos grasos inhibe la xilulosa 5-fosfato, bloqueando la glicólisis y explicando la hiperglicemia.
Sin embargo este estudio utilizó altas concentraciones de glucosa, que podrían inhibir la glucólisis, luego el efecto de la inhibición podría estar dada por la misma glucosa y no por las altas concentraciones de ácidos grasos, tampoco se determinó si el aumento de los ácidos grasos implicaba inhibición del almacenamiento de glicógeno, este dato podría confirmar que realmente la inhibición de la glicólisis se este generando en etapas tempranas del procesamiento.
El incremento de ácidos grasos libres induce inhibición de la glucólisis en músculo
Al parecer, en músculo un incremento de los ácidos grasos libres induce inhibición de la glicólisis, síntesis de glicógeno y disminución de la glucosa 6P. Esto se dedujo de examinar ratas in vivo, el efecto del incremento en los ácidos grasos libres sobre la captación de glucosa, usando resonancia magnética nuclear para medir la tasa de síntesis de glicógeno y glucólisis en músculo simultáneamente (14). Experimentalmente se les infundió glucosa radiomarcada e insulina necesaria para mantener normal los niveles de glucosa plasmática (6nM) a través de un clamp euglucémico. La radiomarca permitió evaluar los destinos metabólicos de carbono y fosfato por resonancia magnética nuclear. Posteriormente se infundió una mezcla de ácidos grasos monoinsaturados y con el aumento de ácidos grasos libres en circulación se determinó el con tenido de glucosa, glicógeno, glucosa 6P, alanina, lactato y glutamato radiomarcado dentro del músculo. Se encontró una disminución significativa de la glicólisis reflejada en la dismi nución de alanina, lactato, glutamato y glicógeno. Esto permite inferir que los ácidos grasos en altas concentraciones estarían bloqueando por algún mecanismo el transporte de glucosa al interior de la célula produciendo así resistencia a la insulina, sin aclarar el mecanismo bioquímico implicado. Probablemente un aumento de utilización del exceso de ácidos grasos por parte de la célula muscular a través de su oxidación disminuya la resistencia a insulina (15).
Otro trabajo evaluó el efecto de una prolongada exposición a altas concentraciones de ácidos grasos libres sobre la síntesis de productos finales de la ruta biosintética de hexosaminas (16). Para esto se hizo una infusión continua durante siete horas de 500 mU/ml de insulina, 25% de glucosa radiomarcada, 1.5 ml/h de Liposin® que es una mezcla de ácidos grasos monoinsaturados que incluye aceite de girasol y aceite de soya. Posterior a la infusión se extrajo tejido muscular y se analizaron las concentraciones de UDP-Nacetil glucosamina y UDP-N-acetil galactosamina, se analizó además la captación intramuscular de glucosa. Se halló una correlación entre la disminución de la captación de la glucosa, de glucógeno y una marcada acumulación de productos finales de la biosíntesis de hexosaminas (se aumentó dos veces el UDPN-acetil glucosamina en las tres primeras horas y disminuyó a las siete horas). La glucosa 6 P se aumentó a las tres horas y se disminuyó a la siete horas.
Para discriminar si los aumentos de UDP-Nacetil glucosamina favorecen la insulino resistencia, es decir, si se disminuye la captación de glucosa en el músculo esquelético, se indujo hiperglucemia. Para esto, se ocasionó una hiperglicemia prolongada con altas concentraciones de glucosa o infundieron altos niveles de UDP-N-acetil glucosamina o de uridina. En los tres casos hubo aumento de UDP-N-acetil glucosamina en el músculo y marcada disminución de la captación de glucosa y de la síntesis de glicógeno. De esta manera se deduce que la insulino resistencia inducida por los ácidos grasos libres o por altas concentraciones de UDP-Nacetil glucosamina se asocia con la disminución de glucosa 6P, sugiriendo defectos en el transporte y la fosforilación de la glucosa (17). Igualmente, hubo una marcada acumulación de productos finales de la biosíntesis de hexosaminas precediendo la insulino resistencia, es decir, disminución de la captación de la glucosa (18,19).
Se concluyó que el incremento en los ácidos grasos libres en músculo esquelético induce insulino resistencia porque inhibe la glicólisis llevando a un incremento en el flujo de fructosa 6 P hacia la vía de las hexosaminas (20-23). Los anteriores estudios realizados en músculo esquelético de rata coinciden en encontrar disminución de concentraciones de glucosa 6P y glucosa cuando se infunde altas concentraciones de ácidos grasos libres sugiriendo que los ácidos grasos libres inhiben el transporte de glucosa. Estos cambios se han asociado con reducción de la fosforilación en tirosina de IRS 1 (sustrato de receptor de insulina 1) y reducción de la actividad de PI3K (fosfatidilinositol 3 cinasa), sugiriendo inhibición de la señal de la insulina probablemente por activación de la cascada de serinas cinasas involucrando a la proteína cinasa C (PKC)(24) (Figura 2).
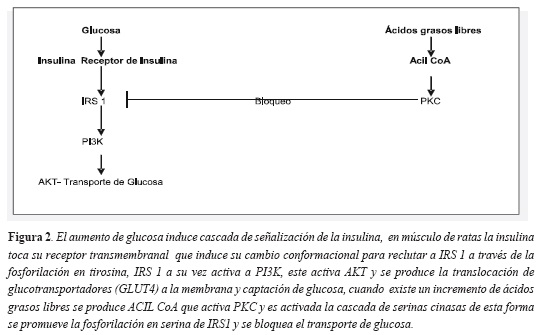
Para determinar el posible rol de la PKC en resistencia a la insulina bajo concentraciones aumentadas de ácidos grasos libres en músculo, se infundió ratas con una emulsión lipídica (compuesta en gran medida por C18:2 1g/kg/h
durante cinco horas) y se extrajo el músculo para analizar la cantidad de ácidos grasos encontrados dentro de la célula muscular, se cuantificó la PKC por medio de un inmunobloting, se evaluaron la fosforilación en tirosina del receptor de la insulina (IR) y la IRS 1 y la fosforilación en serina de IRS a través de ensayos de inmunoprecipitación. Durante cinco horas de estudio se observó un incremento intracelular de C18 CoA, y un incremento de la activación de PKC y reducción de fosforilación en tirosina de IRS 1 y PI3K, con un incremento en la fosforilación en serina 307 de IRS 1. Estos datos soportan la hipótesis de que un incremento de ácidos grasos libres produce un incremento de acil CoA que resulta en una activación de PKC que lleva a un incremento de fosforilación en serina 307 de IRS 1, esto produce la disminución de la activación de IRS 1 y PI3K que resulta en la disminución del transporte de glucosa. Este estudio no aclara si el efecto de PKC sobre IRS 1 esta dado por contacto directo de estas dos moléculas o por vía indirecta (25-28).
Los ácidos grasos libres inducen resistencia a la insulina al activar PKC, un conocido activador de IKKB.
Estudios realizados en ratones señalan a IKKB con un rol potencial en la insulino resistencia. En un estudio experimental administrando altas dosis de salicilatos (4-10 g/día) inhiben el factor nuclear Kappa â(NFKB) y su activador corriente arriba IK kinasa â(IKKB). Este resultado sugiere que altas dosis de salicilatos disminuyen la glucosa sanguínea. Cuando se determinó cual es el efecto de administrar altas dosis de salicilatos en resistencia a insulina severa observada en roedores obesos genéticamente modificados se encontró un aumento de la sensibilidad a la insulina (29). En este trabajo, ratas de cuatro semanas de edad, genéticamente homocigotos y heterocigotos para IKKB, se mantuvieron con una dieta alta en grasas. A estos animales se les determinó las concentraciones de glucosa e insulina. Los resultados mostraron concentraciones consistentemente bajas de glucosa e insulina en roedores heterocigotos comparadas con los homocigotos para IKKB. Estos resultados demuestran que la reducción en el gen d e IKKB, reduce las concentraciones de glucosa e insulina y protege del desarrollo de resistencia a insulina en roedores predispuestos. Probablemente la infusión de ácidos grasos libres activa PKC un conocido activador de IKKB (30,31) (Figura 2). En este trabajo los roedores obesos se alimentaron con una dieta alta en grasas junto con administración intravenosa de aspirina (120 mg/g/día) y se observó reducción en los niveles de glucosa e insulina (29). Este mismo estudio señala que la resistencia a la insulina inducida por los ácidos grasos libres es suprimida por el tratamiento con aspirina en ratones no modificados genéticamente o en roedores heterocigotos para IKKB.
Varios estudios sugieren que la aspirina promueve un aumento de la sensibilidad a la insulina (32-35).
Referencias
1. Sandu O, Song K, Cai W, Zheng F, Uribarri J, Vlassara H. Insulin resistance and type 2 diabetes in high-fat-fed mice are linked to high glycotoxin intake. Diabetes 2005; 54: 2314 - 2319.
2. Chavez J, Holland W, Bar J, Sandhoff K, Summers S. Acid ceramidase overexpression prevents the inhibitory effects of saturated fatty acids on insulin signaling. J. Biol. Chem 2005; 280: 20148 - 20153.
3. Corbould A, Kim Y, Youngren J, Pender C, Kahn B, Lee A, Dunaif A. Insulin resistance in the skeletal muscle of women with PCOS involves intrinsic and acquired defects in insulin signaling Am J Physiol Endocrinol Metab 2005; 288: E1047 - E1054.
4. Park J, Rho H, Kim K, Choe S, Lee Y, Kim J. Overexpression of glucose-6-phosphate dehydrogenase is associated with lipid dysregulation and insulin resistance in obesity. Mol. Cell. Biol 2005; 25: 5146 - 5157.
5. Yu Y, Ginsberg H. Adipocyte signaling and lipid homeostasis: sequelae of insulin-resistant adipose tissue. Circ. Res 2005; 96: 1042 - 1052.
6. Lam T, Carpentier A, Lewis G, Van de Werve G. Mechanisms of the free fatty Acid-induced increase in hepatic glucose production. Am J Physiol Endocrinol Metab 2003;284:E863-E871.
7. Cooney G, Thompson A, Furler S, Ye J. Muscle long-chain acil CoA esters and insulin resistance. Ann.N.Y.Acad.Sci. 2002;967:196-207.
8. Stannard S, Johnson N. Insulin ressitance and elevated triglyceride in muscle. J Physiol. 2003;554.3:595-607.
9. Kosaku U. A mechanism for fatty acid inhibition of glucose utilization in liver, rol of xilulose 5-P. J. Biol.Chem. 1996 ;271:8824-8830.
10. Kabashima T, Kawaguchi T, wadzinski B. Xylulose 5-phosphate mediates glucose-induced lipogenesis by xylulose 5-phosphate-activated protein phosphatese in rat liver. PNAS 2003;100:5107-5112.
11. Lee Y,Li Y,U Uyeda K, Hasemann C. Tissue-specific structure/function differentiation of the liver isoform of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. J. Biol. Chem 2003; 278: 523 - 530.
12. Payne V, Arden C,Wu C, Lange A, Agius L. Dual role of phosphofructokinase-2/fructose bisphosphatase-2 in regulating the compartmentation and expression of glucokinase in hepatocytes Diabetes 2005; 54:1949 - 1957.
13. Collier J, Scott D. Sweet changes: glucose homeostasis can be altered by manipulating genes controlling hepatic glucose metabolism. Mol. Endocrinol. 2004;18: 1051 - 1063.
14. Beat M, Rennings A, Shulman G. 13C y 31 P NMR studies on the effects of increased plasma free fatty acids on intramuscular glucose metabolism in the awake rat. J. Biol. Chem. 1997;272:10464-10464.
15. Perdomo G, Commerford R, Richard A, Adams S. Inscreased b-oxidation in muscle cells enhances insulin-stimulated glucose metabolism and protects against fattyacid-induced insulin resisteance despite intramyocellular lipid accumulation. J.Biol.Chem 2004;279:27177-27186.
16. Hawkins M, Barziliai N, Liu R, Chen W, Rossetti L. Role of the glucosamine pathway in fat induced insulin resistence. J. Clin. Invest. 1997;99:2173-2182.
17. Hanover J, Forsythe M, Hennessey P, Brodigan T, Love D, Ashwell G, Krause M. A Caenorhabditis elegans model of insulin resistance: Altered macronutrient storage and dauer formation in an OGT-1 knockout. PNAS, 2005; 102: 11266 - 11271.
18. McClain D, Hazel M, Parker G, Cooksey R. Adipocytes with increased hexosamine flux exhibit insulin resistance, increased glucose uptake, and increased synthesis and storage of lipid. Am J Physiol Endocrinol Metab 2005; 288: E973 - E979.
19. Lehman D, Fu D, Freeman A, Hunt K, Leach K, Johnson-Pais T, Hamlington J,Dyer T, Arya R, Abboud H, Goring H, Duggirala R, Blangero J, Konrad R, Stern M. A single nucleotide polymorphism in mgea5 encoding o-glcnac-selective n-acetyl-{beta}-d glucosaminidase is associated with type 2 diabetes in mexican Americans. Diabetes 2005; 54: 1214 - 1221.
20. Parker G, Lund K, Taylor R, McClain D. Insulin resistance of glycogen synthase mediated by o-linked n-acetylglucosamine. J. Biol. Chem 2003;278:10022-10027.
21. Weigert C, Klopfer K, Kausch C, Brodbeck K. Palmitate-insuced activation of the hexosamine pathway in human myotubes. Increased expression of glutamine:fructose-6-phosphate aminotransferase. Diabetes 2003;52:650-656.
22. Pouwels M, Tack C, Span P, Olthaar A. Role of Hexosamines in insulin ressitance and nutrient sensing in human adipose and muscle tissue. J.Clin.End.&Metab. 2004;89:5132-5137.
23. Marshall S, Nadeau O, Yamasaki K. Glucosamineinduced activation of glycogen biosynthesis in isolated adipocytes: Evidence for a rapid allosteric control mechanism within the hexosamine biosynthesis pathway J. Biol. Chem 2005; 280 : 11018 - 11024.
24. Yu C, Cline GW, Zhang D, Zong H, Wang Y, Shulman GI. Mechanism by which fatty acids inhibit insulin activation of insulin receptor substrate-1(IRS-1) associated phosphatidylinositol 3 kinase activity in muscle. J. Biol. Chem. 2002;277:50230-50236.
25. Li Y, Soos T, Li X, Wu J, DeGennaro M, Sum X. Protein kinase C q inhibits insulin signaling by phosphoylating IRS1 at Ser1101. J.Biol.Chem. 2004;279:45304-45307.
26. Jessen N, Djurhuus C, Jorgensen J, Jensen L, Moller N, Lund S, Schmitz O. Evidence against a role for insulin-signaling proteins PI 3-kinase and Akt in insulin resistance in human skeletal muscle induced by short-term GH infusion. Am J Physiol Endocrinol Metab 2005; 288: E194 - E199.
27. Bandyopadhyay G, Yu J, Ofrecio J, Olefsky J. Increased p85/55/50 expression and decreased phosphotidylinositol 3-kinase activity in insulin-resistant human skeletal muscle. Diabetes 2005; 54: 2351 - 2359.
28. Kim J, Yeh D, Ver M, Li Y, Carranza A, Conrads A, Veenstra T, Harrington M, Quon M. Phosphorylation of ser24 in the pleckstrin homology domain of insulin receptor substrate-1 by mouse pelle-like kinase/ interleukin-1 receptor-associated kinase: Cross-talk between inflammatory signaling and insulin signaling that may contribute to insulin resistance. J. Biol. Chem 2005; 280: 23173 - 23183.
29. Yuan M, Konstantopoulos N, Lee J, Hansen L, Karin M, Shoelson S. Reversal of obesity and diet induced insulin resistence with salicylates or targeted disruption of IKKB. Science. 2001;293:1673-1677.
30. Kim J, Kim Y, Fillmore J, Moore Y. Prevention of fat-induced insulin resistance bay salicylat. J.Clin.Invest. 2001;108(3):437-446.
31. Gao Z, Zubery A, Quon M, Dong Z. Aspirin inhibits serine phosphorylation of insulin receptor substrate 1 in tumor necrosis factor-treated cells through targeting multiple serine kinases. J.Biol.Chem. 2003;278:24944-24950.
32. Jiang G, Dallas-Yang Q, Liu F, Moller D. Salicylic acid reverses phorbol 12-myristate-13-acetate (PMA)-and tumor necrosis factor a(TNFa)- induced insulin receptor substrate 1 (IRS1)serine 307 phosphorylation and insulin resistance in human embyonic kidney 293 (HEK293) cells. J.Biol.Chem 2003;278:180-186.
33. Cieslik K, Zhu Y, Shtivelband M, and Wu K. Inhibition of p90 ribosomal s6 kinase-mediated ccaat/enhancer-binding protein {beta} activation and cyclooxygenase-2 expression by salicylate. J. Biol. Chem 2005; 280: 18411 - 18417.
34. Kim F, Tysseling K, Rice J, Pham M, Haji L, Gallis B, Baas A, Paramsothy P, Giachelli C, Corson M, and Raines E. Free fatty acid impairment of nitric oxide production in endothelial cells is mediated by ikk â. Arterioscler. Thromb. Vasc. Biol 2005; 25: 989- 994.
35. Röhl M, Pasparakis M, Baudler S, Baumgartl J. Conditional disruption of IkB kinase 2 fail to prevent obesity-induced insulin resistance. J.Clin.Invest. 2004;113:474-481.
Referencias
Sandu O, Song K, Cai W, Zheng F, Uribarri J, Vlassara H. Insulin resistance and type 2 diabetes in high-fat-fed mice are linked to high glycotoxin intake. Diabetes 2005; 54: 2314 - 2319.
Chavez J, Holland W, Bar J, Sandhoff K, Summers S. Acid ceramidase overexpression prevents the inhibitory effects of saturated fatty acids on insulin signaling. J. Biol. Chem 2005; 280: 20148 - 20153.
Corbould A, Kim Y, Youngren J, Pender C, Kahn B, Lee A, Dunaif A. Insulin resistance in the skeletal muscle of women with PCOS involves intrinsic and acquired defects in insulin signaling Am J Physiol Endocrinol Metab 2005; 288: E1047 - E1054.
Park J, Rho H, Kim K, Choe S, Lee Y, Kim J. Overexpression of glucose-6-phosphate dehydrogenase is associated with lipid dysregulation and insulin resistance in obesity. Mol. Cell. Biol 2005; 25: 5146 - 5157.
Yu Y, Ginsberg H. Adipocyte signaling and lipid homeostasis: sequelae of insulin-resistant adipose tissue. Circ. Res 2005; 96: 1042 - 1052.
Lam T, Carpentier A, Lewis G, Van de Werve G. Mechanisms of the free fatty Acid-induced increase in hepatic glucose production. Am J Physiol Endocrinol Metab 2003;284:E863-E871.
Cooney G, Thompson A, Furler S, Ye J. Muscle long-chain acil CoA esters and insulin resistance. Ann.N.Y.Acad.Sci. 2002;967:196-207.
Stannard S, Johnson N. Insulin ressitance and elevated triglyceride in muscle. J Physiol. 2003;554.3:595-607.
Kosaku U. A mechanism for fatty acid inhibition of glucose utilization in liver, rol of xilulose 5-P. J. Biol.Chem. 1996 ;271:8824-8830.
Kabashima T, Kawaguchi T, wadzinski B. Xylulose 5-phosphate mediates glucose-induced lipogenesis by xylulose 5-phosphate-activated protein phosphatese in rat liver. PNAS 2003;100:5107-5112.
Lee Y,Li Y,U Uyeda K, Hasemann C. Tissue-specific structure/function differentiation of the liver isoform of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. J. Biol. Chem 2003; 278: 523 - 530.
Payne V, Arden C,Wu C, Lange A, Agius L. Dual role of phosphofructokinase-2/fructose bisphosphatase-2 in regulating the compartmentation and expression of glucokinase in hepatocytes Diabetes 2005; 54:1949 - 1957.
Collier J, Scott D. Sweet changes: glucose homeostasis can be altered by manipulating genes controlling hepatic glucose metabolism. Mol. Endocrinol. 2004;18: 1051 - 1063.
Beat M, Rennings A, Shulman G. 13C y 31 P NMR studies on the effects of increased plasma free fatty acids on intramuscular glucose metabolism in the awake rat. J. Biol. Chem. 1997;272:10464-10464.
Perdomo G, Commerford R, Richard A, Adams S. Inscreased b-oxidation in muscle cells enhances insulin-stimulated glucose metabolism and protects against fattyacid-induced insulin resisteance despite intramyocellular lipid accumulation. J.Biol.Chem 2004;279:27177-27186.
Hawkins M, Barziliai N, Liu R, Chen W, Rossetti L. Role of the glucosamine pathway in fat induced insulin resistence. J. Clin. Invest. 1997;99:2173-2182.
Hanover J, Forsythe M, Hennessey P, Brodigan T, Love D, Ashwell G, Krause M. A Caenorhabditis elegans model of insulin resistance: Altered macronutrient storage and dauer formation in an OGT-1 knockout. PNAS, 2005; 102: 11266 - 11271.
McClain D, Hazel M, Parker G, Cooksey R. Adipocytes with increased hexosamine flux exhibit insulin resistance, increased glucose uptake, and increased synthesis and storage of lipid. Am J Physiol Endocrinol Metab 2005; 288: E973 - E979.
Lehman D, Fu D, Freeman A, Hunt K, Leach K, Johnson-Pais T, Hamlington J,Dyer T, Arya R, Abboud H, Goring H, Duggirala R, Blangero J, Konrad R, Stern M. A single nucleotide polymorphism in mgea5 encoding o-glcnac-selective n-acetyl-{beta}-d glucosaminidase is associated with type 2 diabetes in mexican Americans. Diabetes 2005; 54: 1214 - 1221.
Parker G, Lund K, Taylor R, McClain D. Insulin resistance of glycogen synthase mediated by o-linked n-acetylglucosamine. J. Biol. Chem 2003;278:10022-10027.
Weigert C, Klopfer K, Kausch C, Brodbeck K. Palmitate-insuced activation of the hexosamine pathway in human myotubes. Increased expression of glutamine:fructose-6-phosphate aminotransferase. Diabetes 2003;52:650-656.
Pouwels M, Tack C, Span P, Olthaar A. Role of Hexosamines in insulin ressitance and nutrient sensing in human adipose and muscle tissue. J.Clin.End.&Metab. 2004;89:5132-5137.
Marshall S, Nadeau O, Yamasaki K. Glucosamineinduced activation of glycogen biosynthesis in isolated adipocytes: Evidence for a rapid allosteric control mechanism within the hexosamine biosynthesis pathway J. Biol. Chem 2005; 280 : 11018 - 11024.
Yu C, Cline GW, Zhang D, Zong H, Wang Y, Shulman GI. Mechanism by which fatty acids inhibit insulin activation of insulin receptor substrate-1(IRS-1) associated phosphatidylinositol 3 kinase activity in muscle. J. Biol. Chem. 2002;277:50230-50236.
Li Y, Soos T, Li X, Wu J, DeGennaro M, Sum X. Protein kinase C q inhibits insulin signaling by phosphoylating IRS1 at Ser1101. J.Biol.Chem. 2004;279:45304-45307.
Jessen N, Djurhuus C, Jorgensen J, Jensen L, Moller N, Lund S, Schmitz O. Evidence against a role for insulin-signaling proteins PI 3-kinase and Akt in insulin resistance in human skeletal muscle induced by short-term GH infusion. Am J Physiol Endocrinol Metab 2005; 288: E194 - E199.
Bandyopadhyay G, Yu J, Ofrecio J, Olefsky J. Increased p85/55/50 expression and decreased phosphotidylinositol 3-kinase activity in insulin-resistant human skeletal muscle. Diabetes 2005; 54: 2351 - 2359.
Kim J, Yeh D, Ver M, Li Y, Carranza A, Conrads A, Veenstra T, Harrington M, Quon M. Phosphorylation of ser24 in the pleckstrin homology domain of insulin receptor substrate-1 by mouse pelle-like kinase/ interleukin-1 receptor-associated kinase: Cross-talk between inflammatory signaling and insulin signaling that may contribute to insulin resistance. J. Biol. Chem 2005; 280: 23173 - 23183.
Yuan M, Konstantopoulos N, Lee J, Hansen L, Karin M, Shoelson S. Reversal of obesity and diet induced insulin resistence with salicylates or targeted disruption of IKKB. Science. 2001;293:1673-1677.
Kim J, Kim Y, Fillmore J, Moore Y. Prevention of fat-induced insulin resistance bay salicylat. J.Clin.Invest. 2001;108(3):437-446.
Gao Z, Zubery A, Quon M, Dong Z. Aspirin inhibits serine phosphorylation of insulin receptor substrate 1 in tumor necrosis factor-treated cells through targeting multiple serine kinases. J.Biol.Chem. 2003;278:24944-24950.
Jiang G, Dallas-Yang Q, Liu F, Moller D. Salicylic acid reverses phorbol 12-myristate-13-acetate (PMA)-and tumor necrosis factor a(TNFa)- induced insulin receptor substrate 1 (IRS1)serine 307 phosphorylation and insulin resistance in human embyonic kidney 293 (HEK293) cells. J.Biol.Chem 2003;278:180-186.
Cieslik K, Zhu Y, Shtivelband M, and Wu K. Inhibition of p90 ribosomal s6 kinase-mediated ccaat/enhancer-binding protein {beta} activation and cyclooxygenase-2 expression by salicylate. J. Biol. Chem 2005; 280: 18411 - 18417.
Kim F, Tysseling K, Rice J, Pham M, Haji L, Gallis B, Baas A, Paramsothy P, Giachelli C, Corson M, and Raines E. Free fatty acid impairment of nitric oxide production in endothelial cells is mediated by ikk â. Arterioscler. Thromb. Vasc. Biol 2005; 25: 989- 994.
Röhl M, Pasparakis M, Baudler S, Baumgartl J. Conditional disruption of IkB kinase 2 fail to prevent obesity-induced insulin resistance. J.Clin.Invest. 2004;113:474-481.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2005 Revista de la Facultad de Medicina

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
-





















