ÍNDICES DE REFRACCIÓN, DENSIDADES Y PROPIEDADES DERIVADAS DE MEZCLAS BINARIAS DE SOLVENTES HIDROXÍLICOS CON LÍQUIDOS IÓNICOS (1-ETIL-3-METILIMIDAZOLIO ETILSULFATO Y 1-METIL-3- METILIMIDAZOLIO METILSULFATO) DE 298,15 A 318,15 K
Palabras clave:
Ecuación de Redlich- Kister, líquidos iónicos, densidad, índices de refracción. (es)de mezclas binarias de agua,
metanol y etanol con 1-Etil-3-metilimidazolio
Etilsulfato (EMIM-EtSO4) y de
etanol con 1-Metil-3-metilimidazolio
Metilsulfato (MMIM-MeSO4) en el rango
de temperatura de (298,15, 308,15 y
318,15) K. Se calcularon los volúmenes
de exceso molar (VM
E ) y la desviación del
índice de refracción (dh), que se ajustaron
a una ecuación polinomial de Redlich-
Kister de orden cuatro.
ÍNDICES DE REFRACCIÓN, DENSIDADES Y PROPIEDADES DERIVADAS DE MEZCLAS BINARIAS DE SOLVENTES HIDROXÍLICOS CON LÍQUIDOS IÓNICOS (1-ETIL-3-METILIMIDAZOLIO ETILSULFATO Y 1-METIL-3-METILIMIDAZOLIO METILSULFATO) DE 298,15 A 318,15 K
REFRACTIVE INDICES, DENSITY AND DERIVATIVE PROPERTIES OF BINARY MIXTURES HYDROXYLIC SOLVENTS WITH IONIC LIQUID (1-ETHYL-3-METHYLIMIDAZOLIUM ETHYLSULFATE AND 1-METHYL-3-METHYLIMIDAZOLIUM METHYLSULFATE) FROM 298.15 K TO 318.15 K
ÍNDICES DE REFRAÇÃO, DENSIDADE E SUAS PROPRIEDADES DERIVADAS DE MISTURAS BINÁRIAS DE SOLVENTES HIDROXÍLICOS COM LÍQUIDO IÔNICO (ETILSULFATO 1-ETIL-3-METILIMIDAZÓLIO E METILSULFATO 1-METIL-3-METILIMIDAZÓLIO) DE 298,15 K AO 318,15 K
Marlon Martínez Reina1, Eliseo Amado González2,3
1 Posgrado en Química. Universidad de Pamplona, Pamplona, Norte de Santander, Colombia.
2 Ibear. Universidad de Pamplona, Pamplona, Norte de Santander, Colombia.
Recibido: 14/03/11 Aceptado: 06/08/11
RESUMEN
Se midieron densidades e índices de refracción de mezclas binarias de agua, metanol y etanol con 1-Etil-3-metilimidazolio Etilsulfato (EMIM-EtSO4) y de etanol con 1-Metil-3-metilimidazolio Metilsulfato (MMIM-MeSO4) en el rango de temperatura de (298,15, 308,15 y 318,15) K. Se calcularon los volúmenes de exceso molar (VME) y la desviación del índice de refracción (dn ), que se ajustaron a una ecuación polinomial de Redlich-Kister de orden cuatro.
Palabras clave: Ecuación de Redlich-Kister, líquidos iónicos, densidad, índices de refracción.
ABSTRACT
Densities and refractive indices of binary mixtures of water, methanol and ethanol with 1-Ethyl-3-methylimidazolium Ethylsulfate (EMIM-EtSO4) and ethanol with 1-Methyl-3-methylimidazolium Methylsulfate (MMIM-MeSO4) in the temperature range (298.15, 308.15 and 318.15) K were measured. The excess of molar volumes (VME) and the deviation of the refractive index (dn ), were fitted to an order fourth polynomial equation of Redlich-Kister.
Key words: Redlich-Kister equation, ionic liquids, density, refractive index
RESUMO
Determinam-se densidades e índices de refração de misturas binárias de água, metanol e etanol com 1-Etil-3-metilimidazólio Etilsulfato (EMIM-EtSO4) e de etanol com 1-Metil-3-metilimidazólio Metilsulfato (MMIM-MeSO4) no intervalo de temperatura (298,15, 308,15 e 318,15) K. Se calcularam os volumes de excesso molar (VME) eo desvio do índice de refração (dn ), ajustados àuma equação polinomial de Redlich-Kisterde ordem quatro.
Palavras-chave: equação de Redlich-Kister, líquidos iônicos, densidade, índice de refração.
INTRODUCCIÓN
Los líquido iónicos(LI) son una familia de compuestos constituida por iones que tienen un punto de fusión inferior a 373,15 K (1, 2), debido a que los LI están formados por iones asimétricos y voluminosos, que presentan fuerzas atractivas más débiles que las sales iónicas convencionales con un alto grado de asimetría que inhibe su cristalización. La estructura de los LI presenta un catión orgánico con un heteroátomo (N, P o S): imidazolio, piridinio, pirrolidinio, tetra alquil amonio, fosfonio y sulfonio asociado a un anión orgánico o inorgánico: alquil sulfato, haluro, nitrato, acetato, tetrafluoroborato, hexafluorofosfato y otros (3).El interés por los LI como disolventes en diferentes procesos químicos se debe a su excelente estabilidad térmica, elevada polaridad, despreciable presión de vapor y a que permanecen inalterados cuando se mezclan con diferentes compuestos orgánicos(4). Sin embargo, la principal característica es que sus propiedades fisicoquímicas pueden ajustarse mediante modificaciones estructurales del catión o el anión; esto hace que los LI puedan convertirse potencialmente en solventes diseñados (5) y se estén estudiando como potenciales solventes verdes para reemplazar los solventes orgánicos volátiles tradicionales en procesos de catálisis, síntesis orgánica, técnicas de separación, electroquímica y química analítica (6-10). Estas aplicaciones requieren datos fisicoquímicos de líquidos iónicos y sus mezclas con otros componentes; en la literatura se reportan propiedades termodinámicas y termo-físicas: densidad, viscosidad, índices de refracción, velocidad del sonido, tensión superficial, conductividad eléctrica, solubilidad y equilibrio de fases de mezclas binarias entre un LI y un solvente molecular (11-15).
En este artículo se reportan las densidades (r) y los índices de refracción de la línea D del sodio (hD) de mezclas binarias de agua, metanol y etanol con 1-Etil-3-Metilimidazolio Etilsulfato (EMIM-EtSO4) y de etanol con 1-Metil-3-Metilimidazolio Metilsulfato (MMIM-MeSO4) a (298,15, 308,15 y 318,15) K y presión atmosférica en el rango de fracción molar. En la Figura 1 se muestra la estructura de los LI EMIM-EtSO4 y MMIM-MeSO4.
Los valores experimentales de densidad e índice de refracción se usan para calcular el volumen de exceso molar (VME) y la desviación del índice de refracción (dn ), ajustados con la ecuación de Redlich-Kister (16) y son analizados en función de las interacciones LI-solvente.
En la Tabla 1 se resumen datos de literatura para volumen de exceso molar y desviaciones del índice de refracción de mezclas binarias de solventes hidroxílicos con LI de Imidazolio.
MATERIALES Y MÉTODOS
Materiales
Reactivos: Agua desionizada (tipo HPLC), Metanol (99,9%) de Mallinckrodt Chemicals, Etanol (99,8%) de Carlo Erba, EMIM-EtSO4 (98,0%) y MMIM-MeSO4 (98,0%) de Sigma Aldrich. El contenido de agua (ppm) en los reactivos se determinó por el método de Karl Fischer en un Titroline KF, metanol 92 ppm, etanol 135 ppm, EMIM-EtSO4 52 ppm y MMIM-MeSO4 37 ppm; los reactivos se guardan en recipientes sellados en desecadores. La densidad y el índice de refracción de los componentes puros se determinan a 298,15 K y se comparan con valores de la literatura en la Tabla 2.
Medidas. Todas las mezclas fueron preparadas inmediatamente antes de realizar la medida de la densidad y de los índices de refracción para evitar variaciones en la composición por evaporación del metanol o etanol o por la naturaleza higroscópica de los líquidos iónicos; taramos frascos de vidrio de unos 50 mL perfectamente limpios y con cuidado introducimos los líquidos separadamente, pesándolos en una balanza Ohaus con una precisión de ± 0,0001 g; el orden de pesada de estos componentes está relacionado con la mayor o menor toxicidad/volatilidad que presentan, siendo el más tóxico/volátil el que se añade en último lugar. Realizadas las pesadas, los frascos se cierran con tapones de rosca y juntas de teflón, para evitar posibles pérdidas por evaporación, que producirían cambios en la fracción molar de las mezclas. La composición de las mezclas se calcula en fracción molar utilizando pesos atómicos recomendadas por la IUPAC en 1996(31); la precisión en fracción molar es ± 0,0002.
La densidad de los componentes puros y sus mezclas binarias fue medida en picnómetros capilares con una capacidad de bulbo de ~25 mL y un capilar con diámetro interno de 1 mm, la marca en el capilar fue calibrada por triplicado usando agua destilada. Las muestras se colocan en un baño de agua a la temperatura de trabajo durante 60 minutos; la temperatura del agua se controla con un termostato digital con una precisión de ± 0,01 K. La incertidumbre en la densidad es ± 0,045% y la precisión en el volumen de exceso molar ( ) es de ± 0,01 cm3 mol1. Para los solventes puros y las mezclas binarias, las medidas se toman por triplicado, y el promedio de los tres valores se introduce en todos los cálculos.
Los índices de refracción son medidos usando la línea D del sodio con un refractómetro termostatado Reichert; la calibración rutinaria del refractómetro fue realizada con una pieza de vidrio con índice de refracción conocido, que forma parte del instrumento. Para la medida del índice de refracción de los sistemas binarios, el instrumento se calibró midiendo por triplicado el índice de refracción de agua destilada y etanol a diferentes temperaturas. El depósito del prisma tiene forma de cono truncado para que al depositar la muestra vierta siempre sobre el prisma que está en el centro del depósito, y al mismo tiempo para evitar que salpique o se derrame algo del líquido de la muestra cuando se deposita. La temperatura a la que se encuentra la muestra posee una precisión de 0,01 K y la iluminación es LED 589,0 nm. La superficie del prisma del refractómetro está termostatizada por una corriente de agua procedente de un baño termostático PolyScience que facilita un flujo de agua a una temperatura constante y con una precisión de 0,01 K. Mediante la termostatización del prisma se consigue que la muestra esté a la temperatura deseada a la hora de hacer la medida. El intervalo de medida para el índice de refracción en el equipo utilizado es 1,3250 a 1,5600.
Se realizaron tres mediciones independientes para cada composición, y el promedio se reportó como índice de refracción. Las mediciones se llevan a cabo a diferentes temperaturas con agua circulando en el refractómetro, la precisión en el índice de refracción es ± 0,0001 unidades y las desviaciones del índice de refracción (dh) se reportan en ± 0,0004 unidades. La precisión en la temperatura de las muestras líquidas es ± 0,01 K.
Las mediciones del índice de refracción de mezcla se realizaron en paralelo a las medidas de densidad, es decir, una vez introducidos los líquidos en los picnómetros, los frascos de vidrio donde se preparó la mezcla también se llevan a la temperatura de trabajo. Obtenido el dato de densidad, la muestra se extrae del frasco de vidrio y se coloca en el refractómetro. La preparación de una única mezcla permite obtener datos de las dos magnitudes diferentes, con el consecuente ahorro de tiempo y reactivos, mientras que al realizarse ambas mediciones a la misma temperatura, la mezcla introducida en el refractómetro está ya a una temperatura muy próxima a la de medida. Este hecho, además de reducir notablemente el tiempo empleado en la medición, contribuye a aumentar la exactitud de la misma, pues disminuye el tiempo de exposición de la mezcla a la atmósfera, reduciéndose las posibles pérdidas por evaporación que modificarían la concentración. De todos modos, para evitar en lo posible dicha evaporación, así como la adsorción de vapor de agua, los líquidos cuyo índice de refracción queremos determinar, se cubren con una tapa de plástico durante el tiempo que dura la medición. En la Figura 2 se resume el montaje experimental.
RESULTADOS Y DISCUSIÓN
Los valores de densidad, índices de refracción, volumen de exceso molar y desviación del índice de refracción para las mezclas binarias a (298,15, 308,15 y 318,15) K en función de fracción molar son presentados en la Tabla 3. La densidad y el índice de refracción de los LI disminuyen cuando se incrementa el contenido de agua o de alcohol en la mezcla.
El volumen de exceso molar ( VME ) y la desviación del índice de refracción (dh), se calculan, respectivamente, usando las ecuaciones:
En estas ecuaciones, xi (i = 1;2) es la fracción molar de cada componente, r y hD son la densidad y los índices de refracción de la mezcla;p i ,hD i y Mi(i = 1;2) son la densidad, los índices de refracción y la masa molar de los componentes puros.
El volumen de exceso molar (VME) y la desviación del índice de refracción (dh) se ajustan a la ecuación polinomial de Redlich-Kister (16):
En esta ecuación, dM es la propiedad del sistema binario (volumen de exceso molar o desviación del índice de refracción), x1 y x2 son la fraccion molar de los componentes, m = 4 es el grado de expansión polinomial y Bp son los parámetros de ajuste.
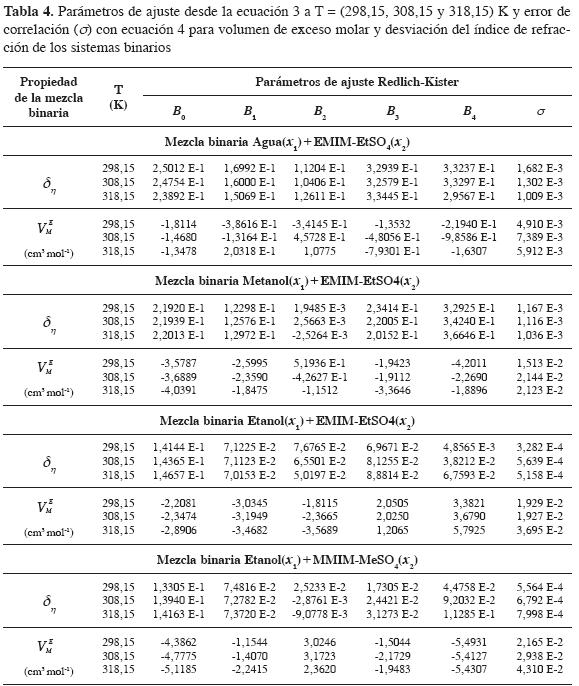
Los parámetros de ajuste usando la ecuación 3 para los sistemas binarios son mostrados en la Tabla 4, para cada mezcla el error de correlación (s) se calcula usando la ecuacion 4, donde zexp es el valor experimental de la propiedad de la mezcla, zpred es el valor obtenido con los parámetros de ajuste polinomial de Redlich-Kister y nDAT es el número de datos experimentales (32).
En la Figura 3 se observa que el volumen de exceso molar es negativo en todo el rango de fracción molar para los cuatro sistemas binarios a 298,15, 308,15 y 318,15 K. Los LI EMIM-EtSO4 y MMIM-MeSO4 contienen grupos etilo y metilo tanto alrededor del grupo imidazolio como unidos al grupo sulfato que deberían desfavorecer la llegada de las moléculas de agua a los sitios intersticiales en el LI, pero aparentemente el efecto en el comportamiento del de los grupos metilo sobre el sulfato sería mayor que en los grupos etilo.
Además, los pares electrónicos del sulfato en los átomos de oxígeno favorecerían la formación de puentes de hidrógeno con las moléculas de agua; para mezclas de agua con otro líquido iónico, Butil Metil Imidazolio Tetrafluoroborato (BMIM-BF4) se han reportado volúmenes de exceso molar positivos (33); en contraste con el agua, los alcoholes adicionales al grupo OH poseen fuerzas intermoleculares débiles por la presencia de cadenas alquílicas que favorecen la ocupación intersticial del líquido iónico. El volumen de exceso molar para los sistemas binarios con alcohol alcanza su máxima desviación a fracciones molares de alcohol x1 > 0,5; es decir, en mezclas ricas en alcohol.
A composición equimolar (x1 = x2 = 0,5) para los sistemas binarios se observa que el volumen de exceso molar se hace menos negativo con el incremento de temperatura para el sistema binario con agua; esta dependencia del volumen de exceso molar con la temperatura en la mezcla Agua(x1)+EMIM-EtSO4(x2) también fue reportado por Rodríguez(26); en contraste, en los binarios con alcoholes, el volumen de exceso molar se hace más negativo con el aumento de temperatura. Este comportamiento también fue reportado por A. B. Pereiro para mezclas binarias de etanol con líquidos iónicos: MMIM-MeSO4, BMIM-MeSO4, BMIM-PF6, HMIM-PF6 y OMIM-PF6 a (293,15, 298,15 y 303,15) K (18).La variación del volumen de exceso molar con la temperatura en los sistemas estudiados se ha interpretado por otros autores: el aumento de la movilidad térmica favorece la ocupación efectiva de sitios intersticiales para el caso de los alcoholes, el volumen de exceso molar se hace más negativo con el incremento de la temperatura (18); en la mezcla con agua, el volumen de exceso molar menos negativo es el resultado de la dependencia de la cantidad de puentes de hidrógeno entre el agua y el anión del líquido iónico con la temperatura. Cuando se incrementa la movilidad térmica disminuye la cantidad de puentes de hidrógeno entre el EtSO4- del líquido iónico y el H-O-H desfavorecidos por la cadena alquílica hidrofóbica del etilsulfato (20, 26).
En la Figura 4 se observan desviaciones positivas del índice de refracción en todo el rango de fracción molar para los cuatro sistemas binarios a 298,15, 308,15 y 318,15 K. La desviación del índice de refracción a composición equimolar se hace menos positiva con el incremento de temperatura para el sistema binario Agua(x1)+EMIM-EtSO4(x2), en los sistemas binarios de LI con alcoholes la desviación del índice de refracción se hace mas positiva con el incremento de temperatura.
Las Figura 5 y Figura 6 muestran una comparación de volúmenes de exceso molar y desviaciones del índice de refracción paralas mezclas binarias a 298,15 K con valores de la literatura.Se observa la siguiente tendencia para más negativos: Etanol(x1)+MMIM-MeSO4(x2) > Metanol(x1)+EMIM-EtSO4(x2) > Etanol(x1)+EMIM-EtSO4 (x2) > Agua(x1)+EMIM-EtSO4(x2) y esta tendencia para dh más positivas: Agua(x1)+EMIM-EtSO4(x2) >Metanol (x1)+EMIM-EtSO4(x2)>Etanol(x1)+EMIM-EtSO4(x2)>Etanol(x1)+MMIM-MeSO4(x2).
Esta tendencia de la magnitud de los volúmenes de exceso molar y desviaciones del índice de refracción en los sistemas estudiados se puede deducir desde el parámetro Bo (Tabla 4) obtenidos desde el ajuste polinomial de Redlich-Kister (16).Valores positivos de Bo indican desviaciones positivas del índice de refracción; los valores de Bo a 298,15 K para las mezclas binarias son: +2,50x10-1, +2,19x10-1, +1,41x10-1 y +1,33x10-1 para Agua(x1)+EMIM-EtSO4(x2),Metanol(x1)+EMIM-EtSO4 (x2), Etanol(x1)+EMIM-EtSO4(x2) y Etanol (x1)+MMIM-MeSO4(x2) respectivamente; la magnitud del parámetro Bo coincide con el orden de la desviación positiva del índice de refracción reportada para estas mezclas en la Figura 4: Agua(x1)+EMIM-EtSO4(x2) > Metanol(x1)+EMIM-EtSO4(x2) > Etanol(x1)+EMIM-EtSO4(x2) > Etanol (x1)+MMIM-MeSO4(x2).
Valores de B0 indican volúmenes de exceso molar negativos.Los valores de B0 a 298,15 K para las mezclas binarias son: -1,81, -3,58, -2,21 y -4,39 para Agua(x1)+EMIM-EtSO4(x2),Metanol(x1)+EMIM-EtSO4(x2), Etanol(x1)+EMIM-EtSO4(x2) y Etanol(x1)+MMIM-MeSO4(x2) respectivamente; el análisis de los valores de B0 sugieren el siguiente orden para mas negativos: Etanol(x1)+MMIM-MeSO4(x2) > Metanol(x1)+EMIM-EtSO4(x2) > Etanol(x1)+EMIM-EtSO4(x2) > Agua(x1)+EMIM-EtSO4(x2).Este orden coincide con la Figura 3 y con lo reportado en la literatura.
Los valores experimentales de densidad e índice de refracción de las mezclas binarias en función de fracción molar y temperatura son ajustados utilizando las siguientes ecuaciones (42):
En estas ecuaciones, S representa la densidad o índice de refracción de la mezcla, Bi es una función polinomial dependiente de la temperatura T (en Kelvin), x1 es la fracción molar y Bij son los parámetros de ajuste.
La Tabla 5 presenta los parámetros de ajuste desde las ecuaciones 5 y 6 para valores de índice de refracción y densidad en función de fracción molar y de temperatura para cada uno de los sistemas binarios considerados en la Tabla 3. El error del ajuste se calculó con la ecuación 4.
En la Figura 7 se muestra la dependencia de la densidad y el índice de refracción con la fracción molar y la temperatura para el sistema binario Etanol(x1)+EMIM-EtSO4(x2); el incremento de la temperatura disminuye la densidad e índice de refracción de las mezclas binarias, el aumento de la fracción molar de etanol en la mezcla representa una disminución de la densidad e índice de refracción del líquido iónico puro. Este sistema presenta volúmenes de exceso molar negativos y desviaciones positivas del índice de refracción con un mínimo o máximo a fracción de etanol de aproximadamente 0,7, como se observa en las Figura 3C y Figura 4C.
CONCLUSIÓN
Densidad e índice de refracción para mezclas binarias de agua, metanol y etanol con EMIM-EtSO4 y de etanol con MMIM-MeSO4 a (298,15, 308,15 y 318,15) K se han determinado experimentalmente en todo el rango de fracción molar. El volumen de exceso molar y la desviación del índice de refracción para estos sistemas se ajustaron a una ecuación polinomial de Redlich-Kister.
El volumen de exceso molar para estos sistemas binarios es negativo en todo el rango de fracción molar a (298,15, 308,15 y 318,15) K; a estas temperaturas las mezclas presentan desviaciones positivas del índice de refracción.
El efecto de la temperatura en el volumen de exceso molar depende de la naturaleza de la mezcla. Para el sistema binario agua + líquido iónico, el aumento de temperatura representa volúmenes de exceso molares menos negativos; para los sistemas binarios alcohol + líquido iónico el aumento de temperatura representa volúmenes de exceso molar más negativos.
AGRADECIMIENTOS
Los autores agradecen a la Dirección de Investigaciones de la Universidad de Pamplona (Convocatoria interna-2007) por la financiación del proyecto.
REFERENCIAS BIBLIOGRÁFICAS
1. Earle, M.; Seddon, K. Ionicliquids. Green solvents for the future. Pure Appl. Chem. 2000. 72(7): 1391-1398.
2. Olivier, H. Recent developments in the use of non-aqueous ionic liquids for two-phase catalysis. J. Mol. Catal. A. 1999. 146: 285-289.
3. Olivier-Bourbigou, H.; Magna, L. Ionic liquids: perspectives for organic and catalytic reactions. J. Mol. Catal. A. 2002. 182-183: 419-437.
4. Zhu, J.; Chen, J.; Li, C; Fei, W. Centrifugal extraction for separation of ethylbenzene and octane using 1-butyl-3-methylimidazolium hexafluorophosphate ionic liquid as extractant. Sep. Purif. Technol. 2007. 56: 237-240.
5. Heintz, A. Recent developments in thermodynamics and thermophysics of non-aqueous mixtures containing ionic liquids. A review. J. Chem. Thermodyn. 2005. 37: 525-535.
6. Welton, T. Room-Temperature Ionic Liquids. Solvents for synthesis and catalysis. Chem. Rev. 1999. 99: 2071-2083.
7. Alonso, L.; Arce, A.; Francisco, M.; Soto, A. Phase behaviour of 1 methyl-3-octylimidazolium bis[trifluoromethylsulfonyl]imide with thiophene and aliphatic hydrocarbons: The influence of n-alkane chain length. Fluid Phase Equilibr. 2008. 263: 176-181.
8. Herbert, M.; Galindo, A.; Montilla, F. Catalytic epoxidation of cyclooctene using molybdenum(VI) compounds and urea-hydrogen peroxide in the ionic liquid [bmim]PF6.Catal. Commun. 2007. 8: 987-990.
9. Chen, P. The assessment of removing strontium and cesium cations from aqueous solutions based on the combined methods of ionic liquid extraction and electrodeposition.Electrochim. Acta. 2007. 52: 5484-5492.
10. Berthod, A.; Ruiz-Angel, M.; Carda-Broch, S. Ionic liquids in separation techniques. J. Chromatogr. A. 2008. 1184: 6-18.
11. Zhu, A.; Wang, J.; Liu, R. A volumetric and viscosity study for the binary mixtures of 1-hexyl-3-methylimidazolium tetrafluoroborate with some molecular solvents. J. Chem. Thermodyn. 2011. 43: 796-799.
12. Kurnia, K.; Taib, M.; Mutalib, M.; Murugesan, T. Densities, refractive indices and excess molar volumes for binary mixtures of protic ionic liquids with methanol at T = (293.15 to 313.15) K. J. Mol.Liq. 2011. 159: 211-219.
13. Shekaari, H.; Mansoori, Y.; Sadeghi, R., Density, speed of sound, and electrical conductance of ionic liquid 1-hexyl-3-methyl-imidazolium bromide in water at different temperatures. J. Chem. Thermodyn. 2008. 40: 852-859.
14. Wang, J.; Jiang, H.; Liu, Y.; Hua, Y. Density and surface tension of pure 1-ethyl-3-methylimidazolium L-lactate ionic liquid and its binary mixtures with water. J. Chem. Thermodyn. 2011. 43: 800-804.
15. Domanska, U. Thermophysical properties and thermodynamic phase behavior of ionic liquids. Thermochim. Acta. 2006. 448: 19-30.
16. Redlich, O.; Kister, A. Algebraic representation of thermodynamic properties and the classification of solutions. Ind. Eng. Chem. 1948. 40: 345-348.
17. Iglesias-Otero, M.; Troncoso, J.; Carballo, E.; Roman, L. Density and refractive index in mixtures of ionic liquids and organic solvents: Correlations and predictions. J. Chem. Thermodyn. 2008. 40: 949-956.
18. Pereiro, A.; Rodríguez, A. Study on the phase behaviour and thermodynamic properties of ionic liquids containing imidazolium cation with ethanol at several temperatures. J. Chem. Thermodyn. 2007. 39: 978-989.
19. Gómez, E.; González, B.; Calvar, N.; Domínguez, A. Excess molar properties of ternary system (ethanol + water + 1,3-dimethylimidazolium methylsulphate) and its binary mixtures at several temperatures. J. Chem. Thermodyn. 2008. 40: 1208-1216.
20. Gómez, E.; González, B.; Calvar, N.; Tojo, E.; Domínguez, A. Physical properties of pure 1-Ethyl-3-methylimidazolium ethylsulfate and its binary mixtures with ethanol and water at several temperatures. J. Chem. Eng. Data. 2006. 51: 2096-2102.
21. González, E.; González, B.; Calvar, N.; Domínguez, A. Physical properties of binary mixtures of the ionic liquid 1-Ethyl-3-methylimidazolium ethyl sulfate with several alcohols at T = (298.15, 313.15, and 328.15) K and Atmospheric Pressure. J. Chem. Eng. Data. 2007. 52: 1641-1648.
22. Pereiro, A.; Rodríguez, A. Thermodynamic properties of ionic liquids in organic solvents from (293.15 to 303.15) K. J. Chem. Eng. Data. 2007. 52: 600-608.
23. Singh, T.; Kumar, A. Physical and excess properties of a room temperature ionic liquid (1-methyl-3-octylimidazolium tetrafluoroborate) with n-alkoxyethanols (C1Em, m = 1 to 3) at T = (298.15 to 318.15) K. J. Chem. Thermodyn. 2008. 40: 417-423.
24. Yu, Z.; Gao, H.; Wang, H.; Chen, L. Densities, excess molar volumes, and refractive properties of the binary mixtures of the amino acid ionic liquid [bmim][Gly] with 1-butanol or isopropanol at T = (298.15 to 313.15) K. J. Chem. Eng. Data. 2011. dx.doi.org/10.1021/je200030k
25. Yu, Z.; Gao, H.; Wang, H.; Chen, L. Densities, viscosities, and refractive properties of the binary mixtures of the amino acid Ionic Liquid [bmim][Ala] with methanol or benzylalcohol at T = (298.15 to 313.15) K. J. Chem. Eng. Data. 2011. 56: 2877-2883.
26. Rodríguez, H.; Brennecke, J. Temperature and composition dependence of the density and viscosity of binary mixtures of water + ionic liquid. J. Chem. Eng. Data. 2006. 51: 2145-2155.
27. Arce, A.; Rodríguez, O.; Soto, A. A comparative study on solvents for separation of tert-amyl ethyl ether and ethanol mixtures. Newexperimental data for 1-ethyl-3-methyl imidazolium ethyl sulfate ionic liquid. Chem. Eng. Sci. 2006. 61: 6929-6935.
28. Pereiro, A.; Rodríguez, A. Ternary (liquid + liquid) equilibria of the azeotrope (ethyl acetate + 2-propanol) with different ionic liquids at T = 298.15 K.J. Chem. Thermodyn. 2007. 39: 1608-1613.
29. Anouti, M.; Caillon-Caravanier, M.; Dridi, Y.; Jacquemin, J.; Hardacre, C.; Lemordant, D. Liquid densities, heat capacities, refractive index and excess quantities for {protic ionic liquids + water} binary system. J. Chem. Thermodyn. 2009. 41: 799-808.
30. Orge, B.; Rodríguez, A.; Canosa, J.; Marino, G.; Iglesias, M.; Tojo, J. Variation of densities. refractive indices and speeds of sound with temperature of methanol or ethanol with hexane, heptane, and octane. J. Chem. Eng. Data. 1999. 44: 1041-1047.
31. IUPAC, ATOMIC WEIGHTS OF THE ELEMENTS 1995 (Technical Report). Pure & Appl. Chem. 1996. 68(12): 2339-2359.
32. Calvar, N.; Gómez, E.; González, B.; Domínguez, A. Experimental densities, refractive indices, and speeds of sound of 12 binary mixtures containing alkanes and aromatic compounds at T = 313.15 K. J. Chem. Thermodyn. 2009. 41: 939-944.
33. Rebelo, L.; Najdanovic-Visak, V.; Visak, P.; Nunes da Ponte, M.; Szydlowski, J.; Cerdeiriça, C.; Troncoso, J.; Romaní, L.; Esperanca, J.; Guedes, H.; de Sousa, H. A Detailed Thermodynamic Analysis of [C4mim][BF4] + Water as a Case Studyto Model Ionic Liquid Aqueous Solutions.Green Chem. 2004. 6: 369-381.
34. García-Miaja, G.; Troncoso, J.; Romaní, L. Excess properties for binary systems ionic liquid + ethanol: Experimental results and theoretical description using the ERAS model. Fluid Phase Equilibr. 2008. 274: 59-67.
35. Lehmann, J.; Rausch, M.; Leipertz, A.; Froba, A. Densities and excess molar volumes for binary mixtures of Ionic Liquid 1-Ethyl-3-methylimidazolium ethylsulfate with solvents. J. Chem. Eng. Data. 2010. 55: 4068-4074.
36. Arce, A.; Rodil, E.; Soto, A. Volumetric and viscosity study for the mixtures of 2-Ethoxy-2-methylpropane, Ethanol, and 1-Ethyl-3-methylimidazolium Ethyl Sulfate Ionic Liquid. J. Chem. Eng. Data. 2006. 51: 1423-1429.
37. Domanska, U.; Pobudkowska, A.; Wisniewska, A. Solubility and excess molar properties of 1,3-Dimethylimidazolium methylsulfate, or 1-Butyl-3 Methylimidazolium Methylsulfate, or 1-Butyl-3-Methylimidazolium Octylsulfate Ionic Liquids with n-Alkanes and Alcohols: Analysis in terms of the PFP and FBT Models. J. Solution Chem. 2006. 35: 311-334.
38. García-Miaja, G.; Troncoso, J.; Romaní, L. Excess enthalpy, density, and heat capacity for binary systems of alkylimidazolium-based ionic liquids + water. J. Chem. Thermodyn. 2009. 41: 161-166.
39. Yang, J.; Lu, X.; Gui, J.; Xu, W.; Li H. Volumetric properties of room temperature ionic liquid 2: The concentrated aqueous solutions of {1-methyl-3-ethylimidazolium ethyl sulfate + water} in a temperature range of 278.2 K to 338.2 K. J. Chem. Thermodyn. 2005. 37: 1250-1255.
40. Deenadayalu, N.; Sen, S.; Sibiya, P. Application of the PFV EoS correlation to excess molar volumes of (1-Ethyl-3-methylimidazolium ethylsulfate + alkanols) at different temperatures. J. Chem. Thermodyn. 2009. 41: 538-548.
41. Hofman, T.; Godon, A.; Nevines, A.; Letcher, T. Densities, excess volumes, isobaric expansivity, and isothermal compressibility of the (1-ethyl-3-methylimidazolium ethylsulfate + methanol) system at temperatures (283.15 to 333.15) K and pressures from (0.1 to 35) MPa. J. Chem. Thermodyn. 2008. 40: 580-591.
42. Iglesias, M.; Torres, A.; González-Olmos, R.; Salvatierra, D. Effect of temperature on mixing thermodynamics of a new ionic liquid: {2-Hydroxy ethylammonium formate (2-HEAF) + short hydroxylic solvents. J. Chem. Thermodyn. 2008. 40: 119-133.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).