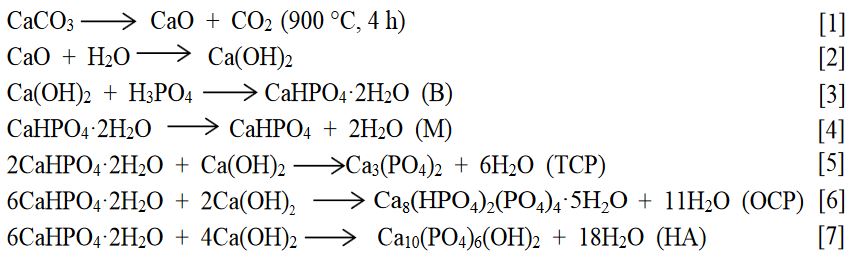Síntesis de monetita pura por reacción heterogénea ácido base.
Synthesis of pure monetite by heterogeneous acid-base reaction
DOI:
https://doi.org/10.15446/rev.colomb.quim.v46n1.59760Palabras clave:
monetita, brushita, DCPA, fosfatos de calcio, DCPD, hidroxiapatita, síntesis de fosfatos (es)monetite, brushite, DCPA, calcium phosphates, DCPD, hydroxyapatite, phosphates synthesis (en)
Se estudiaron cinco variaciones del procedimiento de síntesis de monetita modificando la agitación, la velocidad de adición de ácido fosfórico, la homogenización y la temperatura de secado. Los productos se caracterizaron por difracción de rayos X (DRX), microscopía electrónica de barrido (SEM-EDS), relación Ca/P (por titulación de calcio con permanganato de potasio y valoración colorimétrica de fósforo por la formación del complejo azul de molibdeno) y espectroscopía infrarroja con transformada de Fourier (FTIR). Los resultados de DRX, espectroscopia infrarroja y la relación Ca/P señalan que el fosfato sintetizado corresponde a monetita pura. Se encontró que los factores de síntesis que más afectan las propiedades de composición, estructura cristalina, relación Ca/P y forma y tamaño de grano de los fosfatos sintetizados son la relación estequiométrica de los reactantes y la mecanoactivación de sólido con sobrenadante.
++
Síntesis
de monetita pura por reacción heterogénea ácido-base
Synthesis of pure monetite by heterogeneous acid-base reaction
Síntese de monetita pura por reação heterogênea ácido-base
Davier Olarte Cárdenas1,
Luis Carlos Moreno Aldana1, Edgar Delgado Mejía1,*
Resumen
Se estudiaron cinco variaciones del
procedimiento de síntesis de monetita modificando la agitación, la velocidad de
adición de ácido fosfórico, la homogenización y la temperatura de secado. Los
productos se caracterizaron por difracción de rayos X (DRX), microscopía electrónica
de barrido (SEM-EDS), relación Ca/P (por titulación de
calcio con permanganato de potasio y valoración colorimétrica de fósforo por la
formación del complejo azul de molibdeno) y espectroscopía infrarroja con transformada de Fourier (FTIR). Los
resultados de DRX, espectroscopia infrarroja y la relación Ca/P señalan que el
fosfato sintetizado corresponde a monetita pura. Se encontró que los factores
de síntesis que más afectan las propiedades de composición, estructura
cristalina, relación Ca/P y forma y tamaño de grano de los fosfatos
sintetizados son la relación estequiométrica de los reactantes y la mecanoactivación
de sólido con sobrenadante.
Palabras clave:
monetita, brushita, DCPA, fosfatos de calcio, DCPD, hidroxiapatita, síntesis de
fosfatos.
Abstract
Five variations of the monetite (M) synthesis
were evaluated modifying the stirring, the phosphoric acid addition rate, the homogeneity
and the drying temperature. Products were assessed by means of XRD, FTIR,
SEM-EDS analysis and chemical assay of Ca/P (calcium by titration with
potassium permanganate and phosphorus by colorimetric assessment of the
molybdenum blue complex). X-ray diffraction, infrared spectroscopy and Ca/P
ratio indicate that the synthesized phosphate corresponds to pure monetite. It
was found that the most influential factors affecting composition, crystal size
and Ca/P were stoichiometry and ballmilling mechanoactivation.
Keywords: monetite,
brushite, DCPA, calcium phosphates, DCPD, hydroxyapatite, phosphates synthesis.
Resumo
Foram estudadas cinco variações do
método de síntese de monetita (M) modificando a agitação, a velocidade de
adição do ácido fosfórico, a homogeneização e a temperatura de secagem. Os
produtos foram caracterizados por difratometria de raios X (DRX), microscopia
eletrônica de varredura (SEM-EDS), relação Ca/P (Titulação de cálcio com
permanganato de potássio e titulação de fósforo pela avaliação colorimétrica do
complexo azul de molibdénio), e espectrometria no infra-vermelho com
transformada de Fourier (FTIR). Os resultados de DRX, FTIR e relação Ca/P
indicam que o fosfato sintetizado corresponde a monetita pura. Foi encontrado
que os fatores de síntese que mais afeitam as propriedades da composição,
estrutura cristalina, relação Ca/P e a forma e tamanho de grão dos fosfatos
sintetizados são a proporção estequiométrica e a mecânoativação do solido com o
sobrenadante.
Palavras-chave: monetita, brushita, DCPA, fosfatos de cálcio, DCPD, hidroxiapatita,
síntese de fosfatos.
Introducción
Los fosfatos de calcio son abundantes en la
naturaleza y son parte mayoritaria de los compuestos inorgánicos presentes en
muchos seres vivos por lo que son importantes en la tecnología, la química, la
geología, la odontología y la medicina en donde sobresalen por su aplicación
como biomateriales. Hay más de una docena de fases de ortofosfatos cálcicos, los
más estudiados han sido la hidroxiapatita (HA) y el fosfato tricalcio (TCP por
su sigla inglesa). Las fases más ácidas también tienen aplicaciones pero en
comparación han sido menos estudiadas. Dentro de las cuatro fases ácidas se
encuentran la brushita (B), también conocida como fosfato dicalcico dihidratado,
DCPD (dicalcium phosphate dihydrate), calcio
monohidrógeno ortofosfato dihidrato (nombre IUPAC) o CaHPO4۰2H2O, y la monetita (M) o DCPA
(dicalcium phosphate anhydrous), calcio monohidrógeno ortofosfato anhidro
(nombre IUPAC) o CaHPO4 (1).
Las fracturas, la mineralización anormal y
muchos otros desordenes patológicos hacen necesaria la sustitución, la
reparación de los tejidos duros o el estudio detallado de materiales en que la
M o la B (llamadas DCPs de aquí en adelante cuando se trate de ambas) juegan un
papel importante en forma directa o como parte de cementos biocompatibles para
adhesión o relleno de defectos (2). En algunos cementos los DCPs no son
componentes de partida sino productos del fraguado y posteriormente por la
acción biológica y fisicoquímica se convierten en fases más estables como la
apatita (A) (2-7).
La B se encuentra en mineralizaciones
patológicas como en la pseudogota (o condrocalcinosis, un desorden reumatológico)
en donde se halla DCPD, A y pirofosfato dicálcico dihidratado (8); también se
encuentra en cálculos renales, dentales, urinarios y en lesiones cariosas (9).
Las M y B no existen en tejidos duros sanos y son importantes porque cuando se
someten a condiciones fisiológicas normales (implantes) desaparecen convirtiéndose
en apatitas de tejidos duros sanos.
Los DCPs son metaestables (10) razón por la que
se les adicionan en diferentes proporciones estabilizadores como el pirofosfato
de sodio o el ortofosfato trimagnésico octahidratado, para evitar la degradación
que puede convertirlas en HA, especialmente cuando los DCPs entran en contacto
con agua y medios fisiológicos (11). De aquí se puede inferir que el sodio, el
magnesio, el fosfato y/o el pirofosfato estabilizan los DCPs, es decir, inhiben
las diferentes cinéticas de sus múltiples transformaciones.
Numerosos estudios han demostrado que son
muchos los iones que afectan las propiedades y reacciones de los DCPs
estabilizándolos o también orientando sus reacciones hacia productos diferentes.
LeGeros et al. (12) encontraron que
siempre que usaban soluciones acuosas de Ca2+ con concentraciones
entre 1 y 3 mM y PO43- menor a 10 mM, se producía por
nucleación heterogénea octacalciofosfato (OCP), si además se encontraba Mg2+
con una relación Mg/Ca menor o igual a 1. En el mismo experimento con relación
Mg/Ca mayor que 1 no se produce OCP sino B. Este OCP con más tiempo se
convierte en apatita.
LeGeros et
al. (12) no mencionan transformaciones de la B formada y se puede entender
que esto sucedió porque se tiene una B que contiene magnesio y por lo tanto
está estabilizada y no se modifica. Los resultados fueron muy diferentes cuando
se emplearon soluciones con Ca2+ en concentración 3 mM y PO43-
igual o superior a 10 mM, en donde se obtuvo una nucleación homogénea de
un fosfato cálcico-magnésico amorfo inestable que se transformó en HA, en B, en
whitlockita (W) o en newberyita, dependiendo del valor del cociente Mg/Ca y de
la concentración de PO43-.
Madsen y Pedersen (13) estudiaron el efecto de
14 iones metálicos di y trivalentes sobre las transformaciones de la B. El
magnesio en concentraciones de 10-4 M dirige la reacción de B
convirtiéndose en W y no en OCP o en HA; el plomo induce la precipitación de fosfato
de calcio y el cobre inhibe la conversión de B en OCP. Concluyen que la mayoría
de iones di y trivalentes inhiben la conversión de la B. Si no se tiene un
control de las impurezas, los cementos y demás materiales preparados por
reacción de B o de M pueden terminar en productos diferentes a las apatitas
deseadas (OCP, A, W o fosfatos de calcio amorfos o ACPs por su sigla inglesa) (ver
Tabla 1) que tienen diferentes propiedades mecánicas y biofisicoquímicas.
En el caso de cementos de fosfatos de calcio
que forman B y/o M se ha encontrado que la adición de NaCl (ejemplo de iones
monovalentes) en alta concentración facilita la precipitación de M en tiempos
más cortos y que se obtiene una mezcla de B/M cuyo cociente disminuye de forma
inversamente proporcional con la concentración de NaCl (14).
Suguna y Sekar (15) estudiaron
el efecto del Sr sobre la síntesis y formación de cristales de B y encontraron
que en la síntesis se obtiene B con M y HA. Estos resultados coinciden más o menos con otros estudios del sistema de
DCPs con Sr, pero queda una sombra de duda ya que la M o B empleada por estos
autores se obtuvo por reacción líquido-líquido de una solución de nitrato de
calcio y otra de fosfato de potasio, sin especificar los efectos del anión
nitrato ni del catión potasio sobrantes de la reacción (nitrato de potasio que
queda incluido dentro del sólido de fosfatos de calcio). Ya se ha demostrado
que estos iones monovalentes también tienen efectos sobre las propiedades, la
cinética y las reacciones (14).
Los
fosfatos de calcio, en particular la M y la B, se obtienen por numerosos
métodos, entre los cuales se encuentran la síntesis por vía húmeda, síntesis
por vía seca, proceso sol-gel, proceso hidrotermal y reacción ácido-base, entre
otros (16-22). A través de estos métodos generalmente se obtienen mezclas de varios
fosfatos de calcio con otras impurezas orgánicas
y/o inorgánicas.
Ahora bien, los iones foráneos en la producción
de DCPs provienen de los materiales de partida y del método de síntesis
empleado. Aquellos que se generan en los materiales de partida se minimizan
escogiendo materiales que contengan contaminantes en concentraciones conocidas
y muy pequeñas, además, que el contenido de estabilizantes sea informado correctamente
por el fabricante. La exigencia de estudiar, comprobar y cuantificar las impurezas
y aditivos de los reactivos hace que sea preferible la síntesis in situ.
Los que se generan por el método de síntesis se controlan seleccionando una ruta que no
introduzca iones y que no genere iones diferentes a los de la red cristalina de
los fosfatos de calcio. Se deben evitar métodos que usan sales solubles como
nitratos, acetatos o cloruros de calcio, fosfatos de sodio, potasio o amonio,
que inevitablemente quedan incluidos en los sólidos aún después de sinterizar,
cosa imposible con la M o B. Algunos contaminantes se eliminan cuando se
sinterizan los sólidos para mejorar su cristalinidad, terminar la reacción y
eliminar aditivos como es el caso del amonio, pero dejan vacantes que alteran
la estequiometría del producto. Los métodos que utilizan tensoactivos,
polímeros, defloculantes, emulsionantes pueden producir iones indeseados. Son
numerosos los artículos en que la síntesis se hace en solución por ser mucho
más expedita y fácil. Por ejemplo, el uso de cloruro de calcio y fosfato de
sodio como sales solubles también forman NaCl y este afecta la cinética y la relación
M/B en el producto final (14).
Otros autocontaminantes son el agua y los iones
de calcio y fosfatos cuando no se encuentran en proporciones exactamente
estequiométricas e idénticas con la fase que se desea obtener, debido a que
inducirán en alguna proporción otras fases fosfocálcicas como MCPM, MCPA (ver Tabla
1) para reactantes con Ca/P <1,0 y TCP, OCP, ACP, HA para Ca/P > 1. La
forma de controlar la autocontaminación es trabajar con una estequiometría
precisamente calculada y evitar perder cualquiera de los iones en los pasos de
la síntesis. El control del agua en el producto final es importante pues de lo
contrario se puede terminar con mezclas de M y B que no permiten hacer cálculos
estequiométricos precisos y pueden conducir a fases indeseadas si están en una
reacción.
Con sales como los dos DCPs (M y B) hay
factores limitantes adicionales como su sensibilidad a la temperatura, por lo
que no se pueden terminar las reacciones por tratamiento térmico pues la B
sólida se convierte en M a aprox. 220 °C. Si se calienta en suspensión, la
transformación se da a unos 80 °C (23) y
si se calienta M por encima de 420 °C se convierte en pirofosfato de calcio que
inhibe aún más la conversión en HA.
La transformación de
B en M no es tan sencilla según lo descrito en el artículo de Dosen (23) pues
claramente dice que la temperatura de deshidratación es aproximadamente 220 °C
pero que también se deshidrata a más bajas temperaturas con tiempos más largos.
En este estudio se hallaron dos fases
intermedias entre B y M como una fase amorfa con 0,75 moléculas de agua; la M,
si se sigue deshidratando, sigue perdiendo agua en proporciones no estequiométricas.
La única reacción que no produce especies
residuales diferentes a calcio, fosfato y agua es la de hidróxido de calcio con
ácido fosfórico. Si se deseara facilitar esta reacción realizándola en solución
y no en suspensión se debería usar solución de Ca(OH)2 que sería
impráctica debido a la baja solubilidad del hidróxido en agua [Kps = 5.5 x10-6
o 0.173 g en 100 mL esto es 0,025 M a 20 °C (solubilidad retrógrada)] y para
obtener una mol de B se necesitarían más de 23 litros de agua (24). El uso de
glicerina apenas aumenta la solubilidad en aprox. 50% (25).
Por lo anterior, en este trabajo se empleó
suspensión acuosa del hidróxido. Por tratarse de una reacción heterogénea L/S,
los tiempos se pueden hacer demasiado largos para obligar al H3PO4
líquido a reaccionar con el sólido. Del mismo modo, se ensayaron tres formas de
agitación: la agitación magnética, la mecánica con aspas de teflón® y el
impacto en un molino de bolas. Este último puede romper los granos de Ca(OH)2
que se recubren rápidamente con B u OCP (octacalcio fosfato, ver Tabla 1) o ACP
o hasta HA al contacto con el fosfórico, que por su baja solubilidad (B es la
más soluble con Kps 2,57 x 10-7 o 0,0088 g en 100 mL; OCP
2,51 x 10-99) (26) obstaculizan la reacción (así como el aluminio
detiene su oxidación debido al óxido que se forma en su superficie a pesar de que
exista mucho aluminio metálico adentro y oxígeno afuera en el aire).
Como estos fosfatos son mucho menos solubles
que el hidróxido, pueden parar la reacción por lo que conviene romperlos para
continuar la reacción y lograr una distribución completamente homogénea de
todos los iones. De lo contrario, se tendrán zonas con diferentes fases de
fosfatos de calcio y el producto será una mezcla de ellos como en las
referencias anteriormente citadas. Calentar la reacción no sirve de mucho pues
las solubilidades de B, M e hidróxido de calcio son retrógradas y casi
constantes.
La falta de homogeneidad incrementa las
reacciones consecutivas y favorece la formación de fases con alto cociente
molar Ca/P como la W, el OCP y la HA obtenidas en las referencias. El tiempo de
reacción debe ser corto pues el contacto de DCPs con agua los hidroliza y los
convierte en otras fases, principalmente HA, pero también fases intermedias
como OCP y ACPs que van a contaminar el producto. De esta forma, lograr una
gran homogeneidad ayuda a eliminar la contaminación tipo tres (autoimpurezas) y
elimina el efecto de las reacciones sucesivas y paralelas (reacciones [5], [6]
y [7], entre otras) por concentraciones locales elevadas de calcio y/o bajas de
fosfato alrededor de las partículas sólidas.
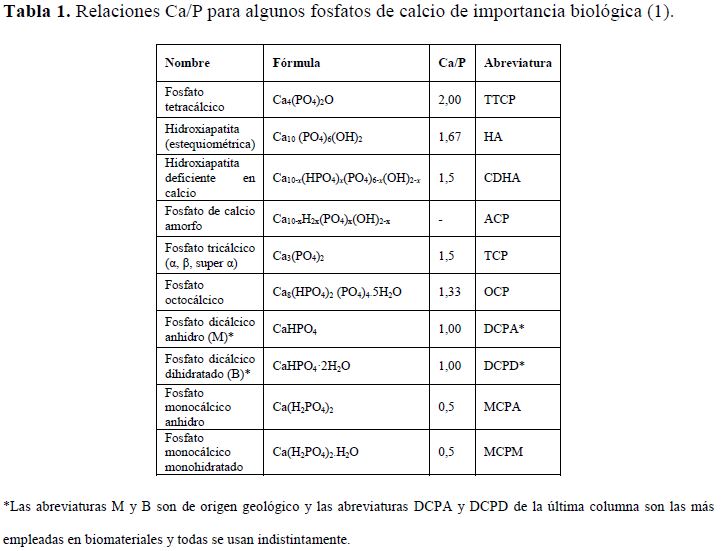
Los
fosfatos de calcio se caracterizan por su relación molar de calcio y fósforo
(Ca/P) que para M es 1,00. En la tabla 1 se muestran las relaciones Ca/P para
algunos fosfatos de calcio.
Tabla
1. Relaciones Ca/P para algunos fosfatos de calcio de importancia
biológica (1).
|
Nombre |
Fórmula |
Ca/P |
Abreviatura |
|
Fosfato tetracálcico |
Ca4(PO4)2O |
2,00 |
TTCP |
|
Hidroxiapatita (estequiométrica) |
Ca10 (PO4)6(OH)2 |
1,67 |
HA |
|
Hidroxiapatita deficiente en calcio |
Ca10-x(HPO4)x(PO4)6-x(OH)2-x
|
1,5 |
CDHA |
|
Fosfato de calcio amorfo |
Ca10-xH2x(PO4)x(OH)2-x |
- |
ACP |
|
Fosfato tricálcico (α, β, super α) |
Ca3(PO4)2 |
1,5 |
TCP |
|
Fosfato octocálcico |
Ca8(HPO4)2 (PO4)4·5H2O |
1,33 |
OCP |
|
Fosfato dicálcico anhidro (M)* |
CaHPO4 |
1,00 |
DCPA* |
|
Fosfato dicálcico dihidratado (B)* |
CaHPO4·2H2O |
1,00 |
DCPD* |
|
Fosfato monocálcico anhidro |
Ca(H2PO4)2 |
0,5 |
MCPA |
|
Fosfato monocálcico
monohidratado |
Ca(H2PO4)2·H2O |
0,5 |
MCPM |
*Las abreviaturas M y B son de origen geológico y las
abreviaturas DCPA y DCPD de la última columna son las más empleadas en
biomateriales y todas se usan indistintamente.
En
este trabajo se estudió la síntesis de M (CaHPO4) por vía ácido-base
en fase heterogénea a partir de ácido fosfórico e hidróxido de calcio y el
efecto de los diferentes factores de síntesis sobre su pureza, composición,
estructura cristalina y morfología.
Las
principales reacciones involucradas en esta síntesis son:
Materiales y métodos
El
óxido de calcio empleado en la síntesis de la M se preparó calcinando carbonato
de calcio grado USP (United States Pharmacopoeia, calidad farmacopea para uso
en humanos, Hermann Schlattermund, CaCO3 sintético de baja densidad,
CaCO3 > 99,0%, partes insolubles en agua < 0,3%; en ácido
acético < 0,2%; en HCl < 0,2%; Cl < 0,025%; F < 0,005%; SO4
< 0,02%; Pb < 10 ppm; As < 3 ppm; Ba no detectable; Fe 0,002%) a 900 °C
hasta peso constante (aproximadamente 4 h). Posteriormente, se sometió a un
proceso de pulverización en un molino de bolas (tanque de 12 cm de altura por
10 cm de diámetro, con 24 bolas de alúmina de 2,5 cm de diámetro) a 74 rpm
durante 4 h. Una suspensión de hidróxido de calcio se obtuvo por adición
cuidadosa de polvo de óxido de calcio sobre exceso de agua desmineralizada bajo
continua agitación magnética. La B se sintetizó agregando sobre la suspensión
de hidróxido de calcio una cantidad estequiométrica de ácido fosfórico (ácido
orto-fosfórico, 85%, d = 1,71 g/L, Merck) bajo agitación continua con agitación
magnética a 106 rpm o con agitador de aspas de teflón a 210 rpm a temperatura
ambiente.
Se realizaron cinco procedimientos de síntesis (Tabla 2) en
los cuales se varió: velocidad de adición del ácido fosfórico, sistema de
agitación, tiempo adicional de agitación luego de agregar el ácido fosfórico,
tiempo de molienda en molino de bolas del producto de reacción antes de secado
y temperatura de secado.
En
los procedimientos P1, P2 y P3 se descartó la solución sobrenadante y en P4 y
P5 los sobrenadantes no se descartaron sino que se vertieron dentro del tanque
del molino de bolas junto con el sólido y se molió. El producto de la reacción de
todos los procedimientos se secó y transformó en M en estufa a temperaturas entre
70 y 150 °C durante 20 h.
Tabla 2. Condiciones
de síntesis.
|
Número
de procedimiento |
P1 |
P2 |
P3 |
P4 |
P5 |
|
Agitación del Ca(OH)2 |
Agit.AM* |
Agit.AM |
Agit.A |
Agit.A |
Agit.A |
|
Tiempo de agitación
del Ca(OH)2 (h) |
2 |
2 |
2 |
12 |
6 |
|
Velocidad de adición de ácido (mL/min) |
40 |
40 |
1,5 |
1,5 |
1,5 |
|
Agitación durante la reacción |
Agit.AM |
Agit.AM |
Agit.A |
Agit.A |
Agit.A |
|
Tiempo adicional de agitación (min) |
180 |
5 |
10 |
10 |
5 |
|
Tiempo de mecanoactivación (molino de bolas) antes de
secado (h) |
0 |
6 |
6 |
6 |
6 |
|
Mecanoactivación con sobrenadante |
No |
No |
No |
Si |
Si |
|
Temperatura de secado (°C) |
70 |
70 |
150 |
70 |
70 |
*Agit. AM =
Agitación magnética, Agit. A = Agitación con aspas
A todos los productos se les realizó el análisis cuantitativo
de calcio por formación de oxalato de calcio y su posterior titulación con
permanganato de potasio y análisis cuantitativo de fósforo colorimétricamente
por la formación de un complejo azul con molibdeno medido a 810 nm, empleando
una curva de calibración con concentración de fósforo entre 2,5 y 5,0 ppm (27, 28).
Las propiedades cristalográficas de las
muestras de fosfatos se determinaron en un equipo de difracción de rayos X
(DRX), marca PANalytical modelo X´Pert MPD y los resultados fueron analizados
empleando los programas PowderX (29) y X'Pert® High Score. La morfología por
microscopía electrónica de barrido y la composición por EDS se determinaron en
un equipo FEI QUANTA 200, equipado con un analizador de energía dispersiva de
rayos X acoplado al microscopio y detectores de electrones secundarios (SE) y
retrodispersados (BSE) . Se realizó el análisis por infrarrojo con
transformadas de Fourier FTIR en un equipo Nicolet iS 10 sobre pastillas de KBr.
Las muestras de M se secaron a 120 °C durante 72 h inmediatamente antes de
realizar los diferentes análisis.
Resultados y
discusión
En la Tabla 3 se muestran los resultados del análisis de
composición de Calcio y fósforo de las muestras obtenidas por los diferentes
procedimientos. En los procedimientos P1, P2 y P3 el cociente molar Ca/P tiene desviaciones
por exceso del 12, 14 y 15% respectivamente respecto del cociente para M o B
puros. Este aparente exceso se debe a que hay demasiado calcio
o defecto de fósforo. El hidróxido de calcio y los fosfatos de calcio son poco
solubles y se encuentran dentro del sólido, mientras que el ácido fosfórico es
muy soluble y se encuentra en el líquido sobrenadante. Al desechar el
sobrenadante suponiendo que la reacción ya está completa, se elimina ácido
fosfórico y sólido sin reaccionar, y el sólido por lo tanto queda con calcio
sin reaccionar y esto incrementa el cociente Ca/P, como se observa en la Tabla
3 para los tres primeros procesos.
En los procedimientos P4 y P5, se mecanoactivó en molino de
bolas el ácido fosfórico del sobrenadante junto con el fosfato de calcio
formado para que, por rompimiento mecánico de las partículas insolubles
formadas, se completara la reacción del exceso de hidróxido de calcio atrapado
dentro de los granos con el ácido fosfórico que no reaccionó. La confirmación
de esta hipótesis se da con el resultado de cociente Ca/P de los productos P4 y
P5. El exceso de calcio favorece la formación de fosfatos ricos en calcio como ocurrió
en P3, donde se encontraron evidencias de HA, cuyo Ca/P esta entre 1,50 y 1,67.
Tabla 3. Resultados del
análisis químico de las muestras.
|
Procedimiento |
Masa
de muestra (g) |
Moles
de Ca/g muestra |
Relación
Ca/P |
|
P1 |
0,5130 |
0,0249 |
1,12 |
|
P2 |
0,5105 |
0,0253 |
1,14 |
|
P3 |
0,5025 |
0,0276 |
1,15 |
|
P4 |
0,5242 |
0,0260 |
1,01 |
|
P5 |
0,5241 |
0,0257 |
1,00 |
De los resultados mostrados en la Tabla 3 y los datos de la
Tabla 2 se puede decir que las condiciones de agitación con aspas o magnética durante
la formación del Ca(OH)2 y la reacción de síntesis del fosfato, la
velocidad de adición del ácido fosfórico y el tiempo adicional de agitación
empleado en este trabajo, no tienen ningún efecto sobre la composición del
producto obtenido y expresado como relación Ca/P. Los factores que afectan
apreciablemente la relación de Ca/P son, por un lado, conservar toda la mezcla
(sólido y sobrenadante) y, por otro lado, el tratamiento en molino de bolas o
mecanoactivación que ayuda a la interacción y a completar la reacción entre el hidróxido
de calcio y el ácido fosfórico adicionados estequiométricamente. Estos
resultados confirman los obtenidos en la síntesis de HA pura en un trabajo
anterior (30).
Esta mecanoactivación también ayuda a la disminución de tamaño
de partícula como se observa en las imágenes de microscopía electrónica de la Figura
1. Del mismo modo, aumenta la velocidad de reacción favoreciendo un tamaño y
forma de partícula más homogénea. En las imágenes se observa que en las
muestras preparadas por el procedimiento P1, sin mecanoactivación, se presentan
algunas partículas de gran tamaño cuyo rango es más amplio que en las muestras
preparadas por los otros procedimientos.
Figura 1. Imágenes de microscopia
electrónica de los fosfatos sintetizados.
La composición de las muestras preparadas por los
procedimientos P4 y P5 indican que en estas muestras se encuentra un fosfato dicálcico
con relación de Ca/P de 1,01 y 1,00 respectivamente; esto se confirma con los
resultados de infrarrojo, rayos X y EDS. El tiempo de agitación con aspas
durante la formación del hidróxido de calcio no afecta las propiedades de
composición, estructurales y morfológicas de los fosfatos sintetizados, como se
puede observar de los resultados de microscopía electrónica, FTIR y difracción
de rayos X para las diferentes muestras.
En la Figura 1 también
se observa que en todas las muestras se presentan partículas con forma y tamaño
irregular. En el caso del procedimiento P1 se observan aglomerados de gran
tamaño, constituidos por granos policristalinos cuyo tamaño de cristalito se
halló por la ecuación de Scherrer. Esto se debe a que esta es la única muestra
que no se sometió al proceso de mecanoactivación en donde, por un lado, se
disminuye el tamaño de partícula y, por otro lado, el mayor tiempo de agitación
después de la reacción posiblemente favoreció la aglomeración de partículas
puesto que no se observan muchas partículas pequeñas sueltas.
En la imagen
correspondiente al fosfato sintetizado por el procedimiento P3 se observan partículas de menor tamaño
y con forma prismática. Lo anterior, permite deducir que la adición lenta del
ácido fosfórico favorece la formación de partículas más pequeñas y el secado a
mayor temperatura favorece la mejor cristalinidad sin modificar apreciablemente
la composición del fosfato obtenido, como lo confirman los resultados de
difracción de rayos X.
En la imagen de microscopía electrónica con electrones
retrodispersados (BSE) para la muestra sintetizada por el procedimiento P3 se
observa que la muestra presenta una composición homogénea de calcio y fósforo a
pesar de la presencia de la autoimpureza de HA (1,67 ≥ Ca/P ≥ 1,5). Este
resultado de microscopía fue similar para las muestras preparadas por los otros
procedimientos.
Los espectros de infrarrojo de los fosfatos sintetizados
por los 5 procedimientos se muestran en la Figura 2. En todos los productos se
observa la presencia de pequeñas bandas a 3427 cm-1 (O-H) y 1654 cm-1
(H-O-H) que indican presencia de agua adsorbida superficial libre en las
muestras de fosfato de calcio (31); las bandas a 2852 y 2397 cm-1
corresponden a vibraciones (P-O-H) características de los fosfatos. Las bandas de 1406 cm-1
(P-O-H), 1132 cm-1 (P-O), 1068 cm-1 (P-O), 997 cm-1
(P-O), 902 cm-1 (P-O-H), 582 cm-1 (O-P-O), 528 cm-1
(O-P-O) son características de los fosfatos ácidos (32-35).
Figura 2. Espectros de infrarrojo de los
fosfatos sintetizados. ♦ Señal de hidroxiapatita.
Para la muestra sintetizada por el procedimiento P3 se
observa una menor transmitancia en la banda localizada a 582 cm-1 y
una pequeña banda adicional a aproximadamente a 3570 cm-1 que
corresponde a estiramientos de OH- de HA, esta pequeña banda indica
un tamaño del orden nanométrico de las partículas del sólido obtenido (36).
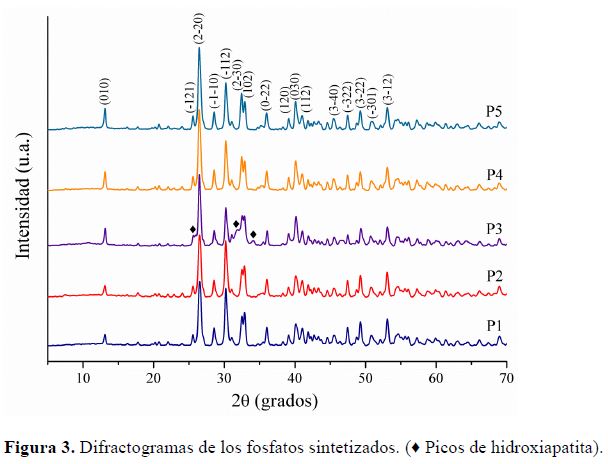
Los difractogramas mostrados en la Figura 3 muestran que
todos los fosfatos sintetizados presentan la estructura de M (CaHPO4)
con fase triclínica; las señales de todas las muestras corresponden al patrón
del archivo JCPDS 009-0080. En todas las muestras, excepto en la muestra
obtenida por procedimiento P3, sólo se
observan señales de la fase M. La muestra preparada por el procedimiento P3
presenta una pequeña cantidad de fase de HA Ca10(PO4)6(OH)2
como impureza y los picos más intensos de esta fase se presentan a
valores de 2θ de 26,0, 31,9 y 34,3°. No se observan picos correspondientes a
las sustancias precursoras de óxido de calcio o hidróxido de calcio u otros
subproductos de reacción, los subproductos de reacción de los procedimientos
P1, P2 y P3 con relación Ca/P mayor que 1,0 no se pudieron determinar por esta
técnica por que posiblemente están en fase amorfa o en cantidades inferiores a
la sensibilidad del equipo.
Así mismo, estos difractogramas indican que si se aumenta
la temperatura de secado hasta 150 °C, se favorece la formación de HA por
hidrólisis de B como proceso simultáneo al secado y se mejora la cristalinidad
de los fosfatos obtenidos. En las muestras preparadas por los procedimientos
P3, P4 y P5 la fase M cristaliza preferencialmente en el plano (2-20), mientras
que en las muestras preparadas por los procedimientos P1 y P2 se observa una
disminución en el crecimiento en esta dirección preferencial y aumenta el
crecimiento en el plano (-112). Con los resultados obtenidos en este trabajo se
puede deducir que el único factor que posiblemente puede favorecer el
crecimiento en esta orientación es la mayor velocidad de adición del ácido
fosfórico.
El tamaño de cristalitos determinado con la fórmula de
Scherrer, empleando el pico de mayor intensidad situado a 26,43° varía entre 23
y 66 nm, para las muestras preparadas por P1 y P3 respectivamente. Las otras
muestras presentan cristalitos con tamaños intermedios, lo que indica que por
este procedimiento de síntesis se obtienen fosfatos con tamaño de cristalito nanométrico.
El fosfato sintetizado por el procedimiento P3 presenta un mayor tamaño de
cristalito debido a la mayor temperatura de secado de 150 °C.
Figura 3. Difractogramas de los fosfatos
sintetizados. (♦ Picos de hidroxiapatita).
En la Figura 4 se muestran los resultados de análisis de
composición por EDS (calibrado con muestras de HA, TCP y MCPM puros tomados 5
veces con áreas de 50 x 50 µm2) de la muestra de fosfato sintetizado
por el procedimiento P5. Con estos resultados la relación de Ca/P es de 1,00
que es igual al resultado obtenido por análisis químico como se observa en la Tabla
3. Se obtuvo una concordancia similar para las muestras preparadas por los
demás procedimientos. Para determinar la fase sintetizada y su pureza es
importante conjugar los resultados de las 4 técnicas analíticas empleadas en
este trabajo.
Figura 4. Resultados del análisis por EDS
del fosfato preparado por el procedimiento P5.
Conclusiones
Se sintetizaron fosfatos con fase M a través de cinco
procedimientos diferentes de reacción entre Ca(OH)2 y H3PO4
en fase heterogénea. Los factores que más afectan las
propiedades de composición y morfología de los fosfatos sintetizados son el
grado de reacción entre los reactantes agregados estequiométricamente y la
mecanoactivación para garantizar la homegeneidad. La temperatura de secado de 150
°C favorece la formación de HA y una mejor cristalinidad en los fosfatos
sintetizados por este procedimiento.
Para obtener un fosfato de calcio con fase M es necesario
garantizar la reacción completa entre el hidróxido de calcio y el ácido
fosfórico por mecanoactivación, incluyendo el sobrenadante y secar el producto
de reacción a 70 °C, como en el caso del procedimiento P5. Por lo anterior, el
fosfato de calcio sintetizado por este procedimiento es el fosfato que presenta
las mejores propiedades de composición química y pureza correspondiente a la fase
de M.
Referencias
1.
Dorozhkin,
S.V. Calcium orthophosphate (CaPO4):
occurrence and properties. Prog.
biomater. 2016, 5, 9-70.
DOI: https://doi.org/10.1007/s40204-015-0045-z.
2.
Tamimi, F.; Sheikh, Z.; Barralet J. Dicalcium
phosphate cements: Brushite and monetite.
Acta
Biomater. 2012, 8, 474–487. DOI: https://doi.org/10.1016/
j.actbio.2011. 08.005.
3.
Sergey, V.; Matthias, E. Biological and medical
significance of calcium phosphates. Angew.
Chem., Int. Ed. 2002, 41, 3130-3146. DOI: https://doi.org/10.1002/1521-3773(20020902)41.
4.
Gbureck, U.; Dembski, S.; Thull, R.; Barralet, J.E.
Factors influencing calcium phosphate cement shelf-life. Biomaterials. 2005, 26,
3691-3697. DOI: http://dx.doi.org/ 10.1016/j.biomaterials.2004.09.036.
5.
Kumar, R.R.; Wang, M., Biomimetic deposition of
hydroxyapatite on brushite single crystals grown by the gel technique. Mater. Lett. 2001, 49, 15-19. DOI:
https://doi.org/10.1016/s0167-577x(00)00333-5.
6.
Charrière, E.; Terrazzoni, S; Pittet, C; Mordasini, P.H.; Dutoit, M.; Lemaître, J. et al. Mechanical
characterization of brushite and hydroxyapatite cements. Biomaterials. 2001, 22,
2937-2645. DOI: https://doi.org/10.1016/s0142-9612(01)00041-2.
7.
Theiss, F.; Apelt, D.; Brand, B.; Kutter, A.; Zlinszky, K.; Bohner, M. et al. Biocompatibility and resorption
of a brushite calcium phosphate cement. Biomaterials.
2005, 26, 4383- 4394. DOI: http://dx.doi.org/ 10.1016/j.biomaterials.2004.11.056.
8.
Dieppe, P. New knowledge of chondrocalcinosis. J. Clin. Pathol. 1978, 31 suppl. 12, 214-222. DOI:
https://doi.org/10.1136/jcp.31.suppl_12.214.
9.
Dorozhikin, S.V.; Calcium orthophopsphates as
biomterials and bioceramics. En: Bioceramics properties, preparation and
applications. Kossler, W.; Fuchs, J. Eds. Nova Biomedical Books: New York,
2009; p. 73.
10. De Aza, P.N.; De Aza,
S. Biocerámicas. En: Biomaterials.
Sastre, R.; De Aza, S.; San Roman, J. Eds. Litográfica Faenza: Faenza (Italia),
2004; p. 55.
11. Corbridge,
D.E.C (Ed). Phosphorus. En: Studies in inorganic chemistry vol. 20. Elsevier Science
B.V., 1995; pp. 169 -305.
12. Cheng, P.T.; Grabher J.J.; LeGeros, R.Z. Effects of magnesium on calcium phosphate
formation. Magnesium. 1988, 7, 123-132.
13. Lundager Madsen, H.E.; Pedersen,
J.B. Influence of foreign metal ions on crystal morphology and transformation
of brushite (CaHP04.2H20). En: Advances in crystal growth
inhibition technologies.
Amjad, Z. Ed. Kluwer Academic/Plenum Publishers: New York, 2000; p. 1.
14. Sahin, E.; Ciftcioglu, M. Monetite promoting
effect of NaCl on brushite cement setting kinetics. J.
Mater. Chem. B. 2013, 1, 2943-2950. DOI: https://doi.org/10.1039/C3TB20130A.
15.
Suguna, K.; Sekar, C. Role of Strontium on the
Crystallization of Calcium Hydrogen Phosphate Dihydrate (CHPD). J. Miner. Mater. Charact. Eng. 2011, 10, 625-636. DOI:
https://doi.org/10.4236/jmmce.2011.107048.
16.
Anee, T.K.; Meenakshi, S.
N.; Arivuoli, D.; Ramasamy, P.; Kalkura, N.S. Influence of an organic and an
inorganic additive on the crystallization of dicalcium phosphate dehydrate. J.
Cryst. Growth. 2005, 285, 380-387. DOI:
https://doi.org/10.1016/j.jcrysgro.2005.08.036.
17. Xian, D. K.; Xiao, D. S.; Jun, B. L.; Fu, Z, C. Mineralization of
calcium phosphate in reverse microemulsion. Curr. Appl. Phys. 2005, 5,
519-521. DOI: https://doi.org/10.1016/j.cap.2005.01.024.
18. Ruiz, S.
C. Propuesta y evaluación de una síntesis rápida y selectiva de algunos
fosfatos de calcio por el método ácido-base., Tesis de maestría,
Universidad Nacional de Colombia, Bogotá, D.C. Colombia, junio 2005.
19.
Kuznetsov, V.N.;
Yanovska, A.A.; Stanislavov, A.S.; Danilchenkoa, S.N.; Kalinkevich,
A.N.; Sukhodub, L.F. Controllability of brushite structural parameters using an
applied magnetic field. Mater. Sc. Eng. C. 2016, 60,
547–553. DOI: http://dx.doi.org/10.1016/ j.msec.2015.11.066.
20.
Arifuzzaman, S.M.;
Rohani, S. Experimental study of brushite precipitation. J. Cryst Growth.
2004, 267, 624-634. DOI: https://doi.org/10.1016/j.jcrysgro.2004.04.024.
21.
Duncan, J.; MacDonald,
J.F.; Hanna, J.V.; Shirosaki, Y.; Hayakawa, S.; Osaka, A.; Skakle, J.M.S.
Gibson, I. R. The role of the chemical composition of monetite on the synthesis
and properties of α-tricalcium phosphate. Mater. Sci. Eng. C. 2014,
34, 123–129. DOI: http://dx.doi.org/10.1016/j.msec.2013.08.038.
22.
Higuita, L.P.; Vargas,
A.F.; Gil, M.J.; Giraldo, L.F. Synthesis and characterization of nanocomposite
based on hydroxyapatite and monetite. Mater. Lett. 2016, 175,
169–172. DOI: https://doi.org/10.1016/j.matlet.2016.04.011.
23.
Dosen, A.; Giese, R. F. Thermal decomposition of brushite CaHPO4·2H2O to
monetite CaHPO4 and the formation of an amorphous phase. Am.
Mineralogist. 2011, 96, 368–373. DOI: https://doi.org/10.2138/am.2011.3544.
24. Selected
solubility products and formation constants. Disponible en: www.csudh.Edu/
oliver/chemdata/data-ksp.htm. [consultado el 7 mayo de 2016].
25. Venter, A.C. U.S. Patent WO2012176151A1, 2012.
26. Dorozhkin, S. Calcium
orthophosphates Occurrence, properties, biomineralization, pathological
calcification and biomimetic applications. Biomatter.
2011, 1, 121-164. DOI: https://doi.org/10.4161/biom.18790.
27. Murphy J.; Riley J.P. A single
solution method for the determination of soluble phosphate in sea water. J.
Mar. Biol. Assoc. 1958, 37,
9-14.
28. ISO 8556 Aluminium ores –
Determination of phosphorus content – Molybdenum blue spectrophotometric method.
1986.
29. Dong, C.
PowderX: Windows-95-based program for powder X-ray diffraction data
processing. J. Appl. Cryst. 1999,
32, 838-838.
30. Ruiz, S.C.; Moreno, L.C.; Delgado E.
Abridged acid-base wet-milling synthesis of high purity hydroxyapatite. Mater. Res. 2008, 11, 187-192. DOI:
https://doi.org/10.1590/s1516-14392008000200013.
31.
Djosic, M.S.; Miskovic-Stankovic, V.B.; Kacarevic-Popovic, Z. M.; Jokic,
B.M.; Bibic, N.; Mitric, M. et al. Electrochemical
synthesis of nanosized monetite powder and its electrophoretic deposition on
titanium. Colloids Surf., A. 2009, 341, 110–117. DOI: https://doi.org/ 10.1016/j.colsurfa.2009.03.046.
32. Tortet,
L.; Gavarri, J. R. Study of protonic mobility in CaHPO4*2H2O
(brushite) and CaHPO4 (monetite) by infrared spectroscopy and
neutron scattering. J. Solid State Chem.
1997, 132, 6-16. DOI:
https://doi.org/10.1006/jssc.1997.7383.
33. Jingwei, X.; Ian, B.S.; Gilson, F.R.
FT-Raman and high-pressure infrared spectroscopic studies of dicalcium
phosphate dehydrate (CaHPO4*2H2O) and anhydrous dicalcium
phosphate (CaHPO4). Spectrochim.
Acta. Part A. 1999, 55, 2801-2809. DOI: https://doi.org/10.1016/s1386-1425(99)00090-6.
34. Trpkovska, M.; Bojan S.; Pavle M.
FTIR reinvestigation of the spectra of synthetic brushite and its partially
deuterated analogues. J. Mol. Struct.
1999, 480-481, 661-666. DOI: https://doi.org/10.1016/s0022-2860(98)00923-5.
35. Elliot, J.C. Structure and chemistry of the apatites and other calcium
orthophosphates. Elsevier: Amsterdam, London, 1994; pp 305-310.
36. Mir, M.; Leiteb, F.L.; Herrmann Junior,
P.S.P.; Pissetti, F.L.; Malta Rossi A.; Lima Moreira, E. et al. XRD, AFM,
IR and TGA Study of Nanostructured Hydroxyapatite. Mater. Res. 2012, 15, 622-627. DOI: https://doi.org/10.1590/s1516-14392012005000069.
Recibido: 25 de agosto de 2016; Aceptado: 12 de diciembre de 2016
Resumen
Se estudiaron cinco variaciones del procedimiento de síntesis de monetita modificando la agitación, la velocidad de adición de ácido fosfórico, la homogenización y la temperatura de secado. Los productos se caracterizaron por difracción de rayos X (DRX), microscopía electrónica de barrido (SEM-EDS), relación Ca/P (por titulación de calcio con permanganato de potasio y valoración colorimétrica de fósforo por la formación del complejo azul de molibdeno) y espectroscopía infrarroja con transformada de Fourier (FTIR). Los resultados de DRX, espectroscopia infrarroja y la relación Ca/P señalan que el fosfato sintetizado corresponde a monetita pura. Se encontró que los factores de síntesis que más afectan las propiedades de composición, estructura cristalina, relación Ca/P y forma y tamaño de grano de los fosfatos sintetizados son la relación estequiométrica de los reactantes y la mecanoactivación de sólido con sobrenadante.
Palabras clave
monetita, brushita, DCPA, fosfatos de calcio, DCPD, hidroxiapatita, síntesis de fosfatos.Abstract
Five variations of the monetite (M) synthesis were evaluated modifying the stirring, the phosphoric acid addition rate, the homogeneity and the drying temperature. Products were assessed by means of XRD, FTIR, SEM-EDS analysis and chemical assay of Ca/P (calcium by titration with potassium permanganate and phosphorus by colorimetric assessment of the molybdenum blue complex). X-ray diffraction, infrared spectroscopy and Ca/P ratio indicate that the synthesized phosphate corresponds to pure monetite. It was found that the most influential factors affecting composition, crystal size and Ca/P were stoichiometry and ballmilling mechanoactivation.
Keywords
monetite, brushite, DCPA, calcium phosphates, DCPD, hydroxyapatite, phosphates synthesis.Resumo
Foram estudadas cinco variações do método de síntese de monetita (M) modificando a agitação, a velocidade de adição do ácido fosfórico, a homogeneização e a temperatura de secagem. Os produtos foram caracterizados por difratometria de raios X (DRX), microscopia eletrônica de varredura (SEM-EDS), relação Ca/P (Titulação de cálcio com permanganato de potássio e titulação de fósforo pela avaliação colorimétrica do complexo azul de molibdénio), e espectrometria no infra-vermelho com transformada de Fourier (FTIR). Os resultados de DRX, FTIR e relação Ca/P indicam que o fosfato sintetizado corresponde a monetita pura. Foi encontrado que os fatores de síntese que mais afeitam as propriedades da composição, estrutura cristalina, relação Ca/P e a forma e tamanho de grão dos fosfatos sintetizados são a proporção estequiométrica e a mecânoativação do solido com o sobrenadante.
Palavras-chave
monetita, brushita, DCPA, fosfatos de cálcio, DCPD, hidroxiapatita, síntese de fosfatos.Introducción
Los fosfatos de calcio son abundantes en la naturaleza y son parte mayoritaria de los compuestos inorgánicos presentes en muchos seres vivos por lo que son importantes en la tecnología, la química, la geología, la odontología y la medicina en donde sobresalen por su aplicación como biomateriales. Hay más de una docena de fases de ortofosfatos cálcicos, los más estudiados han sido la hidroxiapatita (HA) y el fosfato tricalcio (TCP por su sigla inglesa). Las fases más ácidas también tienen aplicaciones pero en comparación han sido menos estudiadas. Dentro de las cuatro fases ácidas se encuentran la brushita (B), también conocida como fosfato dicalcico dihidratado, DCPD (dicalcium phosphate dihydrate), calcio monohidrógeno ortofosfato dihidrato (nombre IUPAC) o CaHPO4 ۰ 2H2O, y la monetita (M) o DCPA (dicalcium phosphate anhydrous), calcio monohidrógeno ortofosfato anhidro (nombre IUPAC) o CaHPO4 (1).
Las fracturas, la mineralización anormal y muchos otros desordenes patológicos hacen necesaria la sustitución, la reparación de los tejidos duros o el estudio detallado de materiales en que la M o la B (llamadas DCPs de aquí en adelante cuando se trate de ambas) juegan un papel importante en forma directa o como parte de cementos biocompatibles para adhesión o relleno de defectos (2). En algunos cementos los DCPs no son componentes de partida sino productos del fraguado y posteriormente por la acción biológica y fisicoquímica se convierten en fases más estables como la apatita (A) (2, 3, 4, 5, 6, 7).
La B se encuentra en mineralizaciones patológicas como en la pseudogota (o condrocalcinosis, un desorden reumatológico) en donde se halla DCPD, A y pirofosfato dicálcico dihidratado (8); también se encuentra en cálculos renales, dentales, urinarios y en lesiones cariosas (9). Las M y B no existen en tejidos duros sanos y son importantes porque cuando se someten a condiciones fisiológicas normales (implantes) desaparecen convirtiéndose en apatitas de tejidos duros sanos.
Los DCPs son metaestables (10) razón por la que se les adicionan en diferentes proporciones estabilizadores como el pirofosfato de sodio o el ortofosfato trimagnésico octahidratado, para evitar la degradación que puede convertirlas en HA, especialmente cuando los DCPs entran en contacto con agua y medios fisiológicos (11). De aquí se puede inferir que el sodio, el magnesio, el fosfato y/o el pirofosfato estabilizan los DCPs, es decir, inhiben las diferentes cinéticas de sus múltiples transformaciones.
Numerosos estudios han demostrado que son muchos los iones que afectan las propiedades y reacciones de los DCPs estabilizándolos o también orientando sus reacciones hacia productos diferentes. LeGeros et al. (12) encontraron que siempre que usaban soluciones acuosas de Ca2+ con concentraciones entre 1 y 3 mM y PO4 3- menor a 10 mM, se producía por nucleación heterogénea octacalciofosfato (OCP), si además se encontraba Mg2+ con una relación Mg/Ca menor o igual a 1. En el mismo experimento con relación Mg/Ca mayor que 1 no se produce OCP sino B. Este OCP con más tiempo se convierte en apatita.
LeGeros et al. (12) no mencionan transformaciones de la B formada y se puede entender que esto sucedió porque se tiene una B que contiene magnesio y por lo tanto está estabilizada y no se modifica. Los resultados fueron muy diferentes cuando se emplearon soluciones con Ca2+ en concentración 3 mM y PO4 3- igual o superior a 10 mM, en donde se obtuvo una nucleación homogénea de un fosfato cálcico-magnésico amorfo inestable que se transformó en HA, en B, en whitlockita (W) o en newberyita, dependiendo del valor del cociente Mg/Ca y de la concentración de PO4 3-.
Madsen y Pedersen (13) estudiaron el efecto de 14 iones metálicos di y trivalentes sobre las transformaciones de la B. El magnesio en concentraciones de 10-4 M dirige la reacción de B convirtiéndose en W y no en OCP o en HA; el plomo induce la precipitación de fosfato de calcio y el cobre inhibe la conversión de B en OCP. Concluyen que la mayoría de iones di y trivalentes inhiben la conversión de la B. Si no se tiene un control de las impurezas, los cementos y demás materiales preparados por reacción de B o de M pueden terminar en productos diferentes a las apatitas deseadas (OCP, A, W o fosfatos de calcio amorfos o ACPs por su sigla inglesa) (ver Tabla 1) que tienen diferentes propiedades mecánicas y biofisicoquímicas.
En el caso de cementos de fosfatos de calcio que forman B y/o M se ha encontrado que la adición de NaCl (ejemplo de iones monovalentes) en alta concentración facilita la precipitación de M en tiempos más cortos y que se obtiene una mezcla de B/M cuyo cociente disminuye de forma inversamente proporcional con la concentración de NaCl (14).
Suguna y Sekar (15) estudiaron el efecto del Sr sobre la síntesis y formación de cristales de B y encontraron que en la síntesis se obtiene B con M y HA. Estos resultados coinciden más o menos con otros estudios del sistema de DCPs con Sr, pero queda una sombra de duda ya que la M o B empleada por estos autores se obtuvo por reacción líquido-líquido de una solución de nitrato de calcio y otra de fosfato de potasio, sin especificar los efectos del anión nitrato ni del catión potasio sobrantes de la reacción (nitrato de potasio que queda incluido dentro del sólido de fosfatos de calcio). Ya se ha demostrado que estos iones monovalentes también tienen efectos sobre las propiedades, la cinética y las reacciones (14).
Los fosfatos de calcio, en particular la M y la B, se obtienen por numerosos métodos, entre los cuales se encuentran la síntesis por vía húmeda, síntesis por vía seca, proceso sol-gel, proceso hidrotermal y reacción ácido-base, entre otros (16, 17, 18, 19, 20, 21, 22). A través de estos métodos generalmente se obtienen mezclas de varios fosfatos de calcio con otras impurezas orgánicas y/o inorgánicas.
Ahora bien, los iones foráneos en la producción de DCPs provienen de los materiales de partida y del método de síntesis empleado. Aquellos que se generan en los materiales de partida se minimizan escogiendo materiales que contengan contaminantes en concentraciones conocidas y muy pequeñas, además, que el contenido de estabilizantes sea informado correctamente por el fabricante. La exigencia de estudiar, comprobar y cuantificar las impurezas y aditivos de los reactivos hace que sea preferible la síntesis in situ.
Los que se generan por el método de síntesis se controlan seleccionando una ruta que no introduzca iones y que no genere iones diferentes a los de la red cristalina de los fosfatos de calcio. Se deben evitar métodos que usan sales solubles como nitratos, acetatos o cloruros de calcio, fosfatos de sodio, potasio o amonio, que inevitablemente quedan incluidos en los sólidos aún después de sinterizar, cosa imposible con la M o B. Algunos contaminantes se eliminan cuando se sinterizan los sólidos para mejorar su cristalinidad, terminar la reacción y eliminar aditivos como es el caso del amonio, pero dejan vacantes que alteran la estequiometría del producto. Los métodos que utilizan tensoactivos, polímeros, defloculantes, emulsionantes pueden producir iones indeseados. Son numerosos los artículos en que la síntesis se hace en solución por ser mucho más expedita y fácil. Por ejemplo, el uso de cloruro de calcio y fosfato de sodio como sales solubles también forman NaCl y este afecta la cinética y la relación M/B en el producto final (14).
Otros autocontaminantes son el agua y los iones de calcio y fosfatos cuando no se encuentran en proporciones exactamente estequiométricas e idénticas con la fase que se desea obtener, debido a que inducirán en alguna proporción otras fases fosfocálcicas como MCPM, MCPA (ver Tabla 1) para reactantes con Ca/P <1,0 y TCP, OCP, ACP, HA para Ca/P > 1. La forma de controlar la autocontaminación es trabajar con una estequiometría precisamente calculada y evitar perder cualquiera de los iones en los pasos de la síntesis. El control del agua en el producto final es importante pues de lo contrario se puede terminar con mezclas de M y B que no permiten hacer cálculos estequiométricos precisos y pueden conducir a fases indeseadas si están en una reacción.
Con sales como los dos DCPs (M y B) hay factores limitantes adicionales como su sensibilidad a la temperatura, por lo que no se pueden terminar las reacciones por tratamiento térmico pues la B sólida se convierte en M a aprox. 220 °C. Si se calienta en suspensión, la transformación se da a unos 80 °C (23) y si se calienta M por encima de 420 °C se convierte en pirofosfato de calcio que inhibe aún más la conversión en HA.
La transformación de B en M no es tan sencilla según lo descrito en el artículo de Dosen (23) pues claramente dice que la temperatura de deshidratación es aproximadamente 220 °C pero que también se deshidrata a más bajas temperaturas con tiempos más largos. En este estudio se hallaron dos fases intermedias entre B y M como una fase amorfa con 0,75 moléculas de agua; la M, si se sigue deshidratando, sigue perdiendo agua en proporciones no estequiométricas.
La única reacción que no produce especies residuales diferentes a calcio, fosfato y agua es la de hidróxido de calcio con ácido fosfórico. Si se deseara facilitar esta reacción realizándola en solución y no en suspensión se debería usar solución de Ca(OH)2 que sería impráctica debido a la baja solubilidad del hidróxido en agua [Kps = 5.5 x10-6 o 0.173 g en 100 mL esto es 0,025 M a 20 °C (solubilidad retrógrada)] y para obtener una mol de B se necesitarían más de 23 litros de agua (24). El uso de glicerina apenas aumenta la solubilidad en aprox. 50% (25).
Por lo anterior, en este trabajo se empleó suspensión acuosa del hidróxido. Por tratarse de una reacción heterogénea L/S, los tiempos se pueden hacer demasiado largos para obligar al H3PO4 líquido a reaccionar con el sólido. Del mismo modo, se ensayaron tres formas de agitación: la agitación magnética, la mecánica con aspas de teflón® y el impacto en un molino de bolas. Este último puede romper los granos de Ca(OH)2 que se recubren rápidamente con B u OCP (octacalcio fosfato, ver Tabla 1) o ACP o hasta HA al contacto con el fosfórico, que por su baja solubilidad (B es la más soluble con Kps 2,57 x 10-7 o 0,0088 g en 100 mL; OCP 2,51 x 10-99) (26) obstaculizan la reacción (así como el aluminio detiene su oxidación debido al óxido que se forma en su superficie a pesar de que exista mucho aluminio metálico adentro y oxígeno afuera en el aire).
Como estos fosfatos son mucho menos solubles que el hidróxido, pueden parar la reacción por lo que conviene romperlos para continuar la reacción y lograr una distribución completamente homogénea de todos los iones. De lo contrario, se tendrán zonas con diferentes fases de fosfatos de calcio y el producto será una mezcla de ellos como en las referencias anteriormente citadas. Calentar la reacción no sirve de mucho pues las solubilidades de B, M e hidróxido de calcio son retrógradas y casi constantes.
La falta de homogeneidad incrementa las reacciones consecutivas y favorece la formación de fases con alto cociente molar Ca/P como la W, el OCP y la HA obtenidas en las referencias. El tiempo de reacción debe ser corto pues el contacto de DCPs con agua los hidroliza y los convierte en otras fases, principalmente HA, pero también fases intermedias como OCP y ACPs que van a contaminar el producto. De esta forma, lograr una gran homogeneidad ayuda a eliminar la contaminación tipo tres (autoimpurezas) y elimina el efecto de las reacciones sucesivas y paralelas (ecuaciones [5], [6] y [7], entre otras) por concentraciones locales elevadas de calcio y/o bajas de fosfato alrededor de las partículas sólidas.
Los fosfatos de calcio se caracterizan por su relación molar de calcio y fósforo (Ca/P) que para M es 1,00. En la tabla 1 se muestran las relaciones Ca/P para algunos fosfatos de calcio.
En este trabajo se estudió la síntesis de M (CaHPO4) por vía ácido-base en fase heterogénea a partir de ácido fosfórico e hidróxido de calcio y el efecto de los diferentes factores de síntesis sobre su pureza, composición, estructura cristalina y morfología. Las principales reacciones involucradas en esta síntesis son [1]-[7]
Materiales y métodos
El óxido de calcio empleado en la síntesis de la M se preparó calcinando carbonato de calcio grado USP (United States Pharmacopoeia, calidad farmacopea para uso en humanos, Hermann Schlattermund, CaCO3 sintético de baja densidad, CaCO3 > 99,0%, partes insolubles en agua < 0,3%; en ácido acético < 0,2%; en HCl < 0,2%; Cl < 0,025%; F < 0,005%; SO4 < 0,02%; Pb < 10 ppm; As < 3 ppm; Ba no detectable; Fe 0,002%) a 900 °C hasta peso constante (aproximadamente 4 h). Posteriormente, se sometió a un proceso de pulverización en un molino de bolas (tanque de 12 cm de altura por 10 cm de diámetro, con 24 bolas de alúmina de 2,5 cm de diámetro) a 74 rpm durante 4 h. Una suspensión de hidróxido de calcio se obtuvo por adición cuidadosa de polvo de óxido de calcio sobre exceso de agua desmineralizada bajo continua agitación magnética. La B se sintetizó agregando sobre la suspensión de hidróxido de calcio una cantidad estequiométrica de ácido fosfórico (ácido orto-fosfórico, 85%, d = 1,71 g/L, Merck) bajo agitación continua con agitación magnética a 106 rpm o con agitador de aspas de teflón a 210 rpm a temperatura ambiente.
Se realizaron cinco procedimientos de síntesis (Tabla 2) en los cuales se varió: velocidad de adición del ácido fosfórico, sistema de agitación, tiempo adicional de agitación luego de agregar el ácido fosfórico, tiempo de molienda en molino de bolas del producto de reacción antes de secado y temperatura de secado.
En los procedimientos P1, P2 y P3 se descartó la solución sobrenadante y en P4 y P5 los sobrenadantes no se descartaron sino que se vertieron dentro del tanque del molino de bolas junto con el sólido y se molió. El producto de la reacción de todos los procedimientos se secó y transformó en M en estufa a temperaturas entre 70 y 150 °C durante 20 h.
A todos los productos se les realizó el análisis cuantitativo de calcio por formación de oxalato de calcio y su posterior titulación con permanganato de potasio y análisis cuantitativo de fósforo colorimétricamente por la formación de un complejo azul con molibdeno medido a 810 nm, empleando una curva de calibración con concentración de fósforo entre 2,5 y 5,0 ppm (27, 28).
Las propiedades cristalográficas de las muestras de fosfatos se determinaron en un equipo de difracción de rayos X (DRX), marca PANalytical modelo X´Pert MPD y los resultados fueron analizados empleando los programas PowderX (29) y X'Pert® High Score. La morfología por microscopía electrónica de barrido y la composición por EDS se determinaron en un equipo FEI QUANTA 200, equipado con un analizador de energía dispersiva de rayos X acoplado al microscopio y detectores de electrones secundarios (SE) y retrodispersados (BSE) . Se realizó el análisis por infrarrojo con transformadas de Fourier FTIR en un equipo Nicolet iS 10 sobre pastillas de KBr. Las muestras de M se secaron a 120 °C durante 72 h inmediatamente antes de realizar los diferentes análisis.
Resultados y discusión
En la Tabla 3 se muestran los resultados del análisis de composición de Calcio y fósforo de las muestras obtenidas por los diferentes procedimientos. En los procedimientos P1, P2 y P3 el cociente molar Ca/P tiene desviaciones por exceso del 12, 14 y 15% respectivamente respecto del cociente para M o B puros. Este aparente exceso se debe a que hay demasiado calcio o defecto de fósforo. El hidróxido de calcio y los fosfatos de calcio son poco solubles y se encuentran dentro del sólido, mientras que el ácido fosfórico es muy soluble y se encuentra en el líquido sobrenadante. Al desechar el sobrenadante suponiendo que la reacción ya está completa, se elimina ácido fosfórico y sólido sin reaccionar, y el sólido por lo tanto queda con calcio sin reaccionar y esto incrementa el cociente Ca/P, como se observa en la Tabla 3 para los tres primeros procesos.
En los procedimientos P4 y P5, se mecanoactivó en molino de bolas el ácido fosfórico del sobrenadante junto con el fosfato de calcio formado para que, por rompimiento mecánico de las partículas insolubles formadas, se completara la reacción del exceso de hidróxido de calcio atrapado dentro de los granos con el ácido fosfórico que no reaccionó. La confirmación de esta hipótesis se da con el resultado de cociente Ca/P de los productos P4 y P5. El exceso de calcio favorece la formación de fosfatos ricos en calcio como ocurrió en P3, donde se encontraron evidencias de HA, cuyo Ca/P esta entre 1,50 y 1,67.
De los resultados mostrados en la Tabla 3 y los datos de la Tabla 2 se puede decir que las condiciones de agitación con aspas o magnética durante la formación del Ca(OH)2 y la reacción de síntesis del fosfato, la velocidad de adición del ácido fosfórico y el tiempo adicional de agitación empleado en este trabajo, no tienen ningún efecto sobre la composición del producto obtenido y expresado como relación Ca/P. Los factores que afectan apreciablemente la relación de Ca/P son, por un lado, conservar toda la mezcla (sólido y sobrenadante) y, por otro lado, el tratamiento en molino de bolas o mecanoactivación que ayuda a la interacción y a completar la reacción entre el hidróxido de calcio y el ácido fosfórico adicionados estequiométricamente. Estos resultados confirman los obtenidos en la síntesis de HA pura en un trabajo anterior (30).
Esta mecanoactivación también ayuda a la disminución de tamaño de partícula como se observa en las imágenes de microscopía electrónica de la Figura 1. Del mismo modo, aumenta la velocidad de reacción favoreciendo un tamaño y forma de partícula más homogénea. En las imágenes se observa que en las muestras preparadas por el procedimiento P1, sin mecanoactivación, se presentan algunas partículas de gran tamaño cuyo rango es más amplio que en las muestras preparadas por los otros procedimientos.
La composición de las muestras preparadas por los procedimientos P4 y P5 indican que en estas muestras se encuentra un fosfato dicálcico con relación de Ca/P de 1,01 y 1,00 respectivamente; esto se confirma con los resultados de infrarrojo, rayos X y EDS. El tiempo de agitación con aspas durante la formación del hidróxido de calcio no afecta las propiedades de composición, estructurales y morfológicas de los fosfatos sintetizados, como se puede observar de los resultados de microscopía electrónica, FTIR y difracción de rayos X para las diferentes muestras.
En la Figura 1 también se observa que en todas las muestras se presentan partículas con forma y tamaño irregular. En el caso del procedimiento P1 se observan aglomerados de gran tamaño, constituidos por granos policristalinos cuyo tamaño de cristalito se halló por la ecuación de Scherrer. Esto se debe a que esta es la única muestra que no se sometió al proceso de mecanoactivación en donde, por un lado, se disminuye el tamaño de partícula y, por otro lado, el mayor tiempo de agitación después de la reacción posiblemente favoreció la aglomeración de partículas puesto que no se observan muchas partículas pequeñas sueltas.
En la imagen correspondiente al fosfato sintetizado por el procedimiento P3 se observan partículas de menor tamaño y con forma prismática. Lo anterior, permite deducir que la adición lenta del ácido fosfórico favorece la formación de partículas más pequeñas y el secado a mayor temperatura favorece la mejor cristalinidad sin modificar apreciablemente la composición del fosfato obtenido, como lo confirman los resultados de difracción de rayos X.
En la imagen de microscopía electrónica con electrones retrodispersados (BSE) para la muestra sintetizada por el procedimiento P3 se observa que la muestra presenta una composición homogénea de calcio y fósforo a pesar de la presencia de la autoimpureza de HA (1,67 ≥ Ca/P ≥ 1,5). Este resultado de microscopía fue similar para las muestras preparadas por los otros procedimientos.
Los espectros de infrarrojo de los fosfatos sintetizados por los 5 procedimientos se muestran en la Figura 2. En todos los productos se observa la presencia de pequeñas bandas a 3427 cm-1 (O-H) y 1654 cm-1 (H-O-H) que indican presencia de agua adsorbida superficial libre en las muestras de fosfato de calcio (31); las bandas a 2852 y 2397 cm-1 corresponden a vibraciones (P-O-H) características de los fosfatos. Las bandas de 1406 cm-1 (P-O-H), 1132 cm-1 (P-O), 1068 cm-1 (P-O), 997 cm-1 (P-O), 902 cm-1 (P-O-H), 582 cm-1 (O-P-O), 528 cm-1 (O-P-O) son características de los fosfatos ácidos (32, 33, 34, 35).
Para la muestra sintetizada por el procedimiento P3 se observa una menor transmitancia en la banda localizada a 582 cm-1 y una pequeña banda adicional a aproximadamente a 3570 cm-1 que corresponde a estiramientos de OH- de HA, esta pequeña banda indica un tamaño del orden nanométrico de las partículas del sólido obtenido (36).
Los difractogramas mostrados en la Figura 3 muestran que todos los fosfatos sintetizados presentan la estructura de M (CaHPO4) con fase triclínica; las señales de todas las muestras corresponden al patrón del archivo JCPDS 009-0080. En todas las muestras, excepto en la muestra obtenida por procedimiento P3, sólo se observan señales de la fase M. La muestra preparada por el procedimiento P3 presenta una pequeña cantidad de fase de HA Ca10(PO4)6(OH)2 como impureza y los picos más intensos de esta fase se presentan a valores de 2θ de 26,0, 31,9 y 34,3°. No se observan picos correspondientes a las sustancias precursoras de óxido de calcio o hidróxido de calcio u otros subproductos de reacción, los subproductos de reacción de los procedimientos P1, P2 y P3 con relación Ca/P mayor que 1,0 no se pudieron determinar por esta técnica por que posiblemente están en fase amorfa o en cantidades inferiores a la sensibilidad del equipo.
Así mismo, estos difractogramas indican que si se aumenta la temperatura de secado hasta 150 °C, se favorece la formación de HA por hidrólisis de B como proceso simultáneo al secado y se mejora la cristalinidad de los fosfatos obtenidos. En las muestras preparadas por los procedimientos P3, P4 y P5 la fase M cristaliza preferencialmente en el plano (2-20), mientras que en las muestras preparadas por los procedimientos P1 y P2 se observa una disminución en el crecimiento en esta dirección preferencial y aumenta el crecimiento en el plano (-112). Con los resultados obtenidos en este trabajo se puede deducir que el único factor que posiblemente puede favorecer el crecimiento en esta orientación es la mayor velocidad de adición del ácido fosfórico.
El tamaño de cristalitos determinado con la fórmula de Scherrer, empleando el pico de mayor intensidad situado a 26,43° varía entre 23 y 66 nm, para las muestras preparadas por P1 y P3 respectivamente. Las otras muestras presentan cristalitos con tamaños intermedios, lo que indica que por este procedimiento de síntesis se obtienen fosfatos con tamaño de cristalito nanométrico. El fosfato sintetizado por el procedimiento P3 presenta un mayor tamaño de cristalito debido a la mayor temperatura de secado de 150 °C.
En la Figura 4 se muestran los resultados de análisis de composición por EDS (calibrado con muestras de HA, TCP y MCPM puros tomados 5 veces con áreas de 50 x 50 µm2) de la muestra de fosfato sintetizado por el procedimiento P5. Con estos resultados la relación de Ca/P es de 1,00 que es igual al resultado obtenido por análisis químico como se observa en la Tabla 3. Se obtuvo una concordancia similar para las muestras preparadas por los demás procedimientos. Para determinar la fase sintetizada y su pureza es importante conjugar los resultados de las 4 técnicas analíticas empleadas en este trabajo.
Conclusiones
Se sintetizaron fosfatos con fase M a través de cinco procedimientos diferentes de reacción entre Ca(OH)2 y H3PO4 en fase heterogénea. Los factores que más afectan las propiedades de composición y morfología de los fosfatos sintetizados son el grado de reacción entre los reactantes agregados estequiométricamente y la mecanoactivación para garantizar la homegeneidad. La temperatura de secado de 150 °C favorece la formación de HA y una mejor cristalinidad en los fosfatos sintetizados por este procedimiento.
Para obtener un fosfato de calcio con fase M es necesario garantizar la reacción completa entre el hidróxido de calcio y el ácido fosfórico por mecanoactivación, incluyendo el sobrenadante y secar el producto de reacción a 70 °C, como en el caso del procedimiento P5. Por lo anterior, el fosfato de calcio sintetizado por este procedimiento es el fosfato que presenta las mejores propiedades de composición química y pureza correspondiente a la fase de M.
Referencias
Referencias
Dorozhkin, S.V. Calcium orthophosphate (CaPO4): occurrence and properties. Prog. biomater. 2016, 5, 9-70. DOI: http://dx.doi.org/10.1007/s40204-015-0045-z.
Tamimi, F.; Sheikh, Z.; Barralet J. Dicalcium phosphate cements: Brushite and monetite. Acta Biomater. 2012, 8, 474–487. DOI: http://dx.doi.org/10.1016/ j.actbio.2011. 08.005.
Sergey, V.; Matthias, E. Biological and medical significance of calcium phosphates. Angew. Chem., Int. Ed. 2002, 41, 3130-3146. DOI: http://dx.doi.org/10.1002/1521-3773(20020902)41.
Gbureck, U.; Dembski, S.; Thull, R.; Barralet, J.E. Factors influencing calcium phosphate cement shelf-life. Biomaterials. 2005, 26, 3691-3697. DOI: http://dx.doi.org/10.1016/j.biomaterials.2004.09.036.
Kumar, R.R.; Wang, M., Biomimetic deposition of hydroxyapatite on brushite single crystals grown by the gel technique. Mater. Lett. 2001, 49, 15-19. DOI: https://doi.org/10.1016/s0167-577x(00)00333-5.
Charrière, E.; Terrazzoni, S; Pittet, C; Mordasini, P.H.; Dutoit, M.; Lemaître, J. et al. Mechanical characterization of brushite and hydroxyapatite cements. Biomaterials. 2001, 22, 2937-2645. DOI: https://doi.org/10.1016/s0142-9612(01)00041-2.
Theiss, F.; Apelt, D.; Brand, B.; Kutter, A.; Zlinszky, K.; Bohner, M. et al. Biocompatibility and resorption of a brushite calcium phosphate cement. Biomaterials. 2005, 26, 4383- 4394. DOI: http://dx.doi.org/ 10.1016/j.biomaterials.2004.11.056.
Dieppe, P. New knowledge of chondrocalcinosis. J. Clin. Pathol. 1978, 31 suppl. 12, 214-222. DOI: https://doi.org/10.1136/jcp.31.suppl_12.214.
Dorozhikin, S.V.; Calcium orthophopsphates as biomterials and bioceramics. En: Bioceramics properties, preparation and applications. Kossler, W.; Fuchs, J. Eds. Nova Biomedical Books: New York, 2009; p. 73.
De Aza, P.N.; De Aza, S. Biocerámicas. En: Biomaterials. Sastre, R.; De Aza, S.; San Roman, J. Eds. Litográfica Faenza: Faenza (Italia), 2004; p. 55.
Corbridge, D.E.C (Ed). Phosphorus. En: Studies in inorganic chemistry vol. 20. Elsevier Science B.V., 1995; pp. 169 -305.
Cheng, P.T.; Grabher J.J.; LeGeros, R.Z. Effects of magnesium on calcium phosphate formation. Magnesium. 1988, 7, 123-132.
Lundager Madsen, H.E.; Pedersen, J.B. Influence of foreign metal ions on crystal morphology and transformation of brushite (CaHP04.2H20). En: Advances in crystal growth inhibition technologies. Amjad, Z. Ed. Kluwer Academic/Plenum Publishers: New York, 2000; p. 1.
Sahin, E.; Ciftcioglu, M. Monetite promoting effect of NaCl on brushite cement setting kinetics. J. Mater. Chem. B. 2013, 1, 2943-2950. DOI: https://doi.org/10.1039/C3TB20130A.
Suguna, K.; Sekar, C. Role of Strontium on the Crystallization of Calcium Hydrogen Phosphate Dihydrate (CHPD). J. Miner. Mater. Charact. Eng. 2011, 10, 625-636. DOI: https://doi.org/10.4236/jmmce.2011.107048.
Anee, T.K.; Meenakshi, S. N.; Arivuoli, D.; Ramasamy, P.; Kalkura, N.S. Influence of an organic and an inorganic additive on the crystallization of dicalcium phosphate dehydrate. J. Cryst. Growth. 2005, 285, 380-387. DOI: https://doi.org/10.1016/j.jcrysgro.2005.08.036.
Xian, D. K.; Xiao, D. S.; Jun, B. L.; Fu, Z, C. Mineralization of calcium phosphate in reverse microemulsion. Curr. Appl. Phys. 2005, 5, 519-521. DOI: https://doi.org/10.1016/j.cap.2005.01.024.
Ruiz, S. C. Propuesta y evaluación de una síntesis rápida y selectiva de algunos fosfatos de calcio por el método ácido-base., Tesis de maestría, Universidad Nacional de Colombia, Bogotá, D.C. Colombia, junio 2005.
Kuznetsov, V.N.; Yanovska, A.A.; Stanislavov, A.S.; Danilchenkoa, S.N.; Kalinkevich, A.N.; Sukhodub, L.F. Controllability of brushite structural parameters using an applied magnetic field. Mater. Sc. Eng. C. 2016, 60, 547–553. DOI: http://dx.doi.org/10.1016/ j.msec.2015.11.066.
Arifuzzaman, S.M.; Rohani, S. Experimental study of brushite precipitation. J. Cryst Growth. 2004, 267, 624-634. DOI: https://doi.org/10.1016/j.jcrysgro.2004.04.024.
Duncan, J.; MacDonald, J.F.; Hanna, J.V.; Shirosaki, Y.; Hayakawa, S.; Osaka, A.; Skakle, J.M.S. Gibson, I. R. The role of the chemical composition of monetite on the synthesis and properties of α-tricalcium phosphate. Mater. Sci. Eng. C. 2014, 34, 123–129. DOI: http://dx.doi.org/10.1016/j.msec.2013.08.038.
Higuita, L.P.; Vargas, A.F.; Gil, M.J.; Giraldo, L.F. Synthesis and characterization of nanocomposite based on hydroxyapatite and monetite. Mater. Lett. 2016, 175, 169–172. DOI: http://dx.doi.org/10.1016/j.matlet.2016.04.011.
Dosen, A.; Giese, R. F. Thermal decomposition of brushite CaHPO4•2H2O to monetite CaHPO4 and the formation of an amorphous phase. Am. Mineralogist. 2011, 96, 368–373. DOI: http://dx.doi.org/10.2138/am.2011.3544.
Selected solubility products and formation constants. Disponible en: www.csudh.Edu/ oliver/chemdata/data-ksp.htm. [consultado el 7 mayo de 2016].
Venter, A.C. U.S. Patent WO2012176151A1, 2012.
Dorozhkin, S. Calcium orthophosphates Occurrence, properties, biomineralization, pathological calcification and biomimetic applications. Biomatter. 2011, 1, 121-164. DOI: http://dx.doi.org/10.4161/biom.18790.
Murphy J.; Riley J.P. A single solution method for the determination of soluble phosphate in sea water. J. Mar. Biol. Assoc. 1958, 37, 9-14.
ISO 8556 Aluminium ores – Determination of phosphorus content – Molybdenum blue spectrophotometric method. 1986.
Dong, C. PowderX: Windows-95-based program for powder X-ray diffraction data processing. J. Appl. Cryst. 1999, 32, 838-838.
Ruiz, S.C.; Moreno, L.C.; Delgado E. Abridged acid¬-base wet-milling synthesis of high purity hydroxyapatite. Mater. Res. 2008, 11, 187-192. DOI: https://doi.org/10.1590/s1516-14392008000200013.
Djosic, M.S.; Miskovic-Stankovic, V.B.; Kacarevic-Popovic, Z. M.; Jokic, B.M.; Bibic, N.; Mitric, M. et al. Electrochemical synthesis of nanosized monetite powder and its electrophoretic deposition on titanium. Colloids Surf., A. 2009, 341, 110–117. DOI: http://dx.doi.org/ 10.1016/j.colsurfa.2009.03.046.
Tortet, L.; Gavarri, J. R. Study of protonic mobility in CaHPO4*2H2O (brushite) and CaHPO4 (monetite) by infrared spectroscopy and neutron scattering. J. Solid State Chem. 1997, 132, 6-16. DOI: https://doi.org/10.1006/jssc.1997.7383.
Jingwei, X.; Ian, B.S.; Gilson, F.R. FT-Raman and high-pressure infrared spectroscopic studies of dicalcium phosphate dehydrate (CaHPO4*2H2O) and anhydrous dicalcium phosphate (CaHPO4). Spectrochim. Acta. Part A. 1999, 55, 2801-2809. DOI: https://doi.org/10.1016/s1386-1425(99)00090-6.
Trpkovska, M.; Bojan S.; Pavle M. FTIR reinvestigation of the spectra of synthetic brushite and its partially deuterated analogues. J. Mol. Struct. 1999, 480-481, 661-666. DOI: https://doi.org/10.1016/s0022-2860(98)00923-5.
Elliot, J.C. Structure and chemistry of the apatites and other calcium orthophosphates. Elsevier: Amsterdam, London, 1994; pp 305-310.
Mir, M.; Leiteb, F.L.; Herrmann Junior, P.S.P.; Pissetti, F.L.; Malta Rossi A.; Lima Moreira, E. et al. XRD, AFM, IR and TGA Study of Nanostructured Hydroxyapatite. Mater. Res. 2012, 15, 622-627. DOI: https://doi.org/10.1590/s1516-14392012005000069.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).