Transamidación y transamidación-reducción de N-benciltiramina con DMF
Transamidation and transamidation-reduction of N-benzyltyramine with DMF
Transamidação e transamidação-redução de N-benziltiramina com DMF
DOI:
https://doi.org/10.15446/rev.colomb.quim.v47n1.63976Palabras clave:
Tiramina, carboxamida, Leuckart-Wallach, dimetilformamida (es)carboxamide, dimethylformamide, Leuckart-Wallach, tyramine (en)
carboxamida, dimetilformamida, Leuckart-Wallach, tiramina (pt)
La tiramina y la N-benciltiramina reaccionan con formaldehído para formar azaciclofanos por medio de condensaciones tipo Mannich aromáticas y reaccionan con aldehídos no enolizables para formar las respectivas bases de Schiff. En este artículo se presenta la síntesis inesperada de N-bencil-N-formiltiramina y N-bencil-N-metiltiramina por medio de reacciones de transamidación y de transamidación-reducción de N-benciltiramina con N,N-dimetilformamida. Para explicar el curso de la reacción se propuso un mecanismo que involucra la formilación de N-benciltiramina y posterior reducción de Leuckart-Wallach inducida por ácido fórmico generado in situ.
Red de Revistas Científicas de América Latina y el Caribe, España y Portugal
Orgánica y Bioquímica
Transamidación y transamidación-reducción de N-benciltiramina con DMF
Transamidation and transamidation-reduction of N-benzyltyramine with DMF
Transamidação e transamidação-redução de N-benziltiramina com DMF
Transamidación y transamidación-reducción de N-benciltiramina con DMF
Revista Colombiana de Química, vol. 47, núm. 1, 2018
Universidad Nacional de Colombia
Recepción: 10 Abril 2017
Aprobación: 07 Junio 2017
Resumen: La tiramina y la N-benciltiramina reaccionan con formaldehído para formar azaciclofanos por medio de condensaciones tipo Mannich aromáticas y reaccionan con aldehídos no enolizables para formar las respectivas bases de Schiff. En este artículo se presenta la síntesis inesperada de N-bencil-N-formiltiramina y N-bencil-N-metiltiramina por medio de reacciones de transamidación y de transamidación-reducción de N-benciltiramina con N,N-dimetilformamida. Para explicar el curso de la reacción se propuso un mecanismo que involucra la formilación de N-benciltiramina y posterior reducción de Leuckart-Wallach inducida por ácido fórmico generado in situ.
Palabras clave: carboxamida, dimetilformamida, Leuckart-Wallach, tiramina.
Abstract: Tyramine and N-benzyltyramine react with formaldehyde to form azacyclophanes by means of aromatic Mannich reactions and react with non-enolizable aldehydes to form the respective Schiff bases. In this paper we present the unexpected synthesis of N-formyl-N-benzyltyramine and N-methyl-N-benzyltyramine by means of transamidation and transamidation-reduction of N-benzyltyramine with N,N-dimethylformamide. A reaction mechanism involving formylation of N-benzyltiramine followed by a Leuckart-Wallach reduction is proposed for rationalising such transformation.
Keywords: carboxamide, dimethylformamide, Leuckart-Wallach, tyramine.
Resumo: A tiramina e a N-benziltiramina reagem com formaldeído para formar azaciclofanos por meio de reações de Mannich aromáticas e reagem com aldeídos não-enolizáveis para formar as respectivas bases de Schiff. Neste trabalho apresenta-se a síntese inesperada de N-formil-N-benziltiramina e N-metil-N-benziltiramina por meio de transamidação e transamidação-redução de N-benziltiramina promovida pela N,N-dimetilformamida. Propõe-se um mecanismo de reação que envolve a formilação de N-benziltiramina seguida por uma redução de Leuckart-Wallach induzida pelo ácido fórmico gerado in situ.
Palavras-chave: carboxamida, dimetilformamida, Leuckart-Wallach, tiramina.
Introducción
Las β-feniletilaminas son conocidas por su actividad sobre el sistema nervioso central (neurotransmisores), por sus efectos psicotrópicos y por ser precursores en la síntesis y biosíntesis de moléculas de interés químico y biológico ( 1 - 7 ).
La tiramina (p-hidroxifeniletilamina) es una β-feniletilamina simpaticomimética que incrementa la presión arterial y estimula los músculos lisos. Este fármaco ha sido ampliamente usado en estudios sobre la fisiología y fisiopatología del sistema nervioso simpático y su influencia en el sistema cardiovascular ( 8 ).
La tiramina (1) reacciona con aldehídos aromáticos para formar las respectivas bases de Schiff (2) y con formaldehido para formar un azaciclofano pentacíclico (3) producto de una doble condensación tipo Mannich entre dos moléculas de tiramina y cuatro de formaldehído (Figura 1) ( 9 , 10 ).

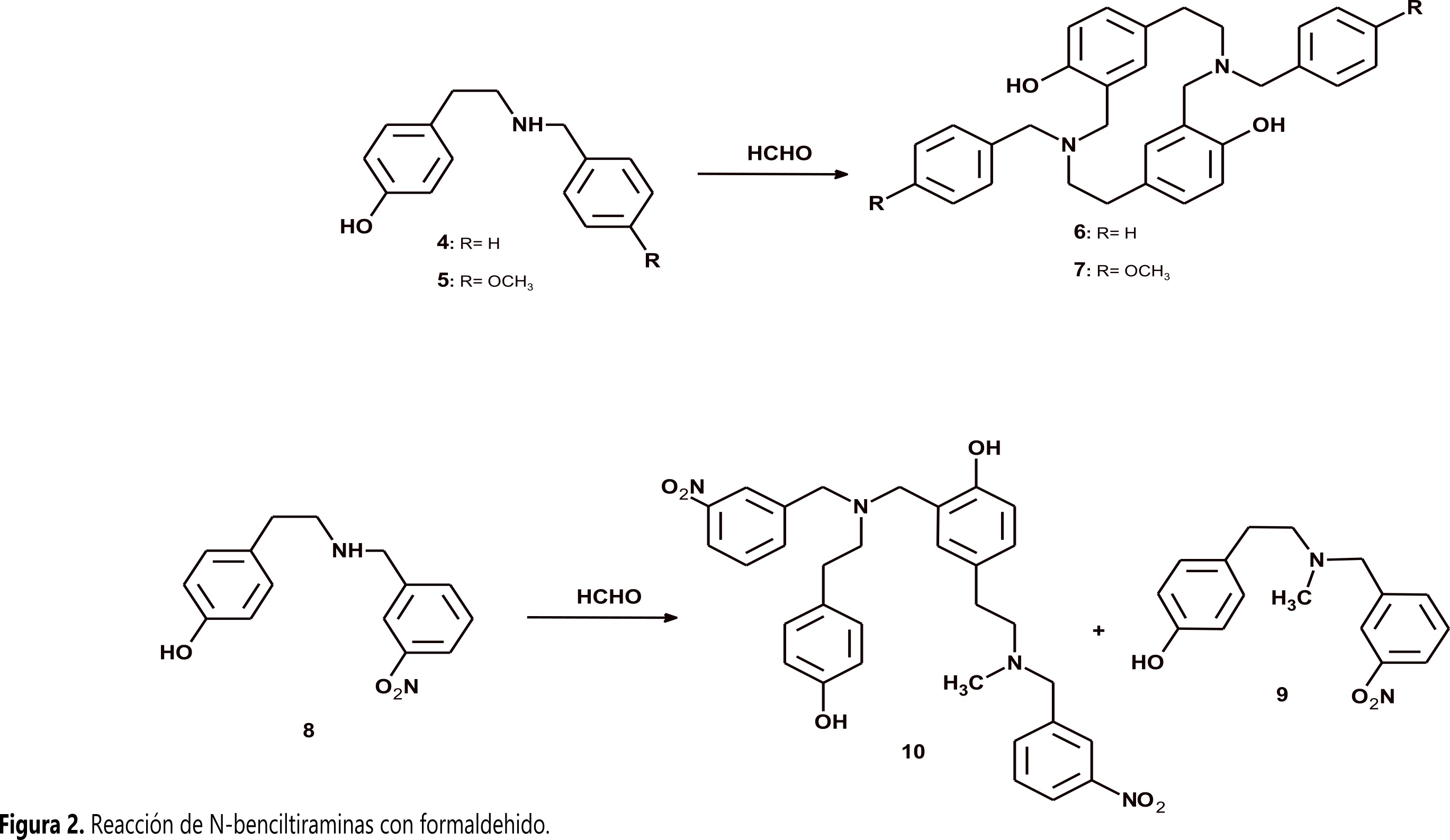
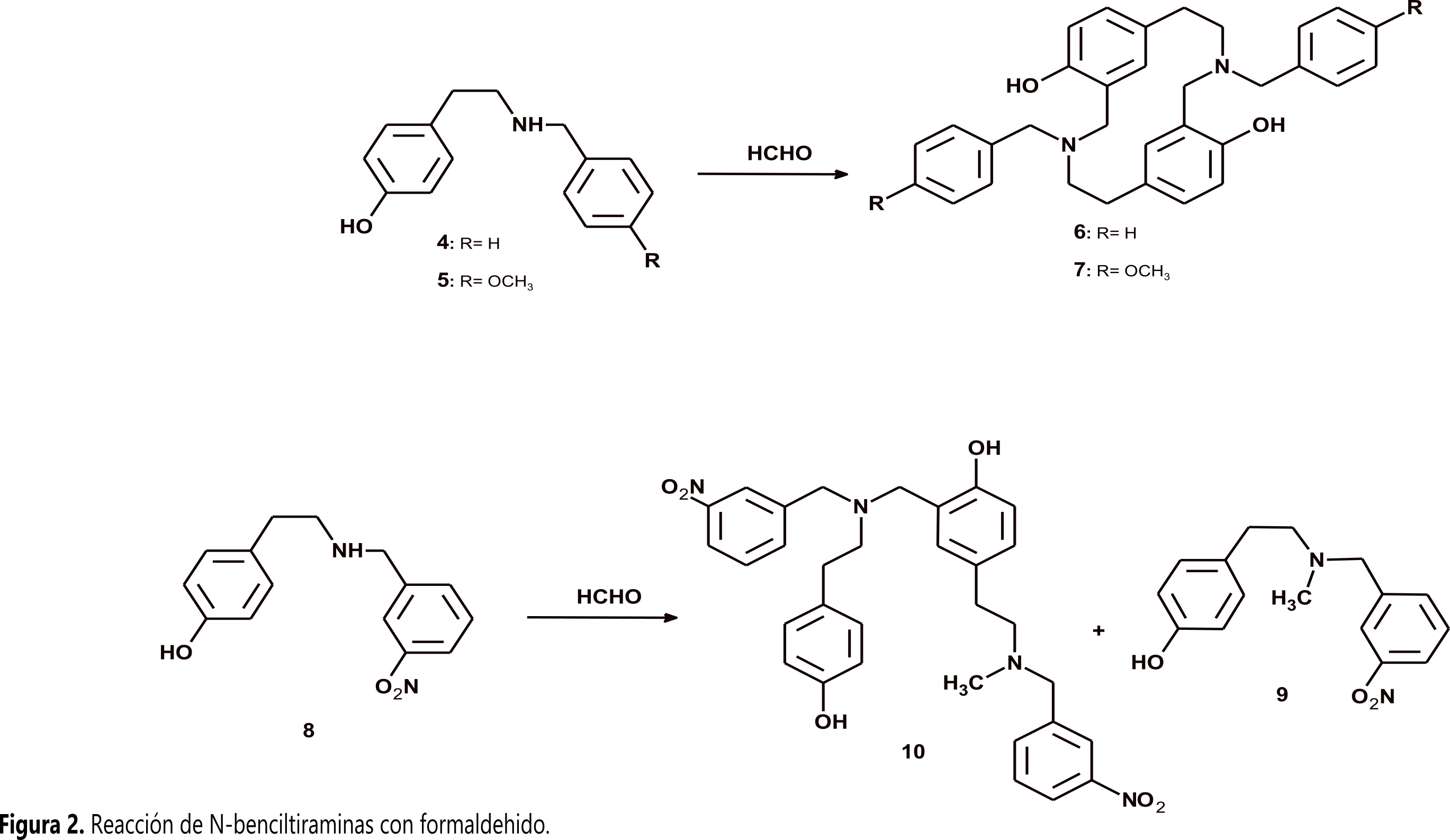
N-benciltiramina (4) y (N-(4-metoxibencil)tiramina (5) reaccionan con formaldehído por medio de una reacción tipo Mannich para formar los respectivos azaciclofanos (6-7), mientras que (N-(3-nitrobencil)tiramina (8) produce una mezcla compleja cuyos productos mayoritarios son N-bencil-N-metiltiramina (9) y un dímero conformado por dos 4 unidas por un metileno con una de las benciltiraminas N-metilada (10) (Figura 2). La metilación en los productos 9 y 10 ocurre por medio de una reacción de EschweilerClarke con ácido fórmico generado in situ (11).
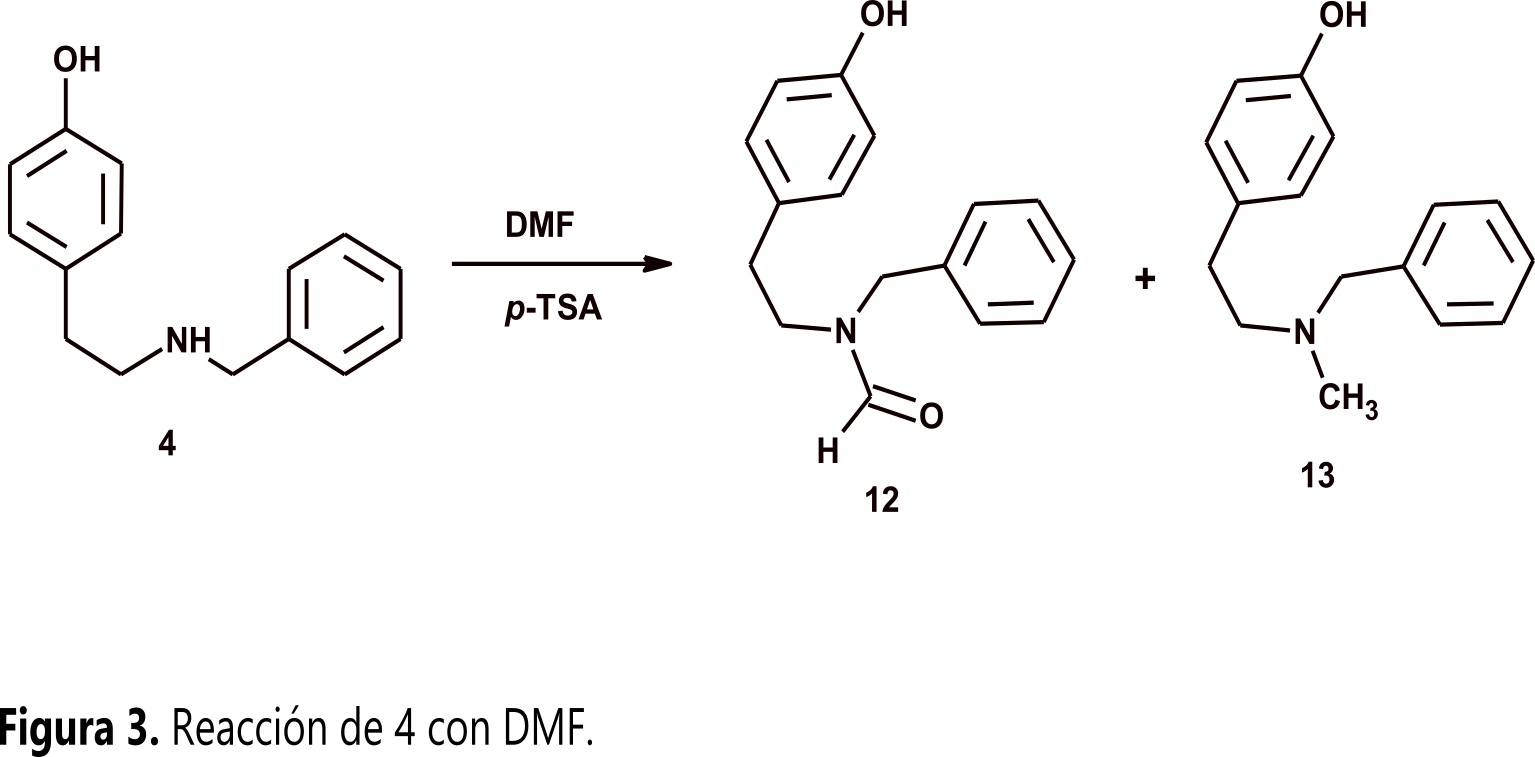
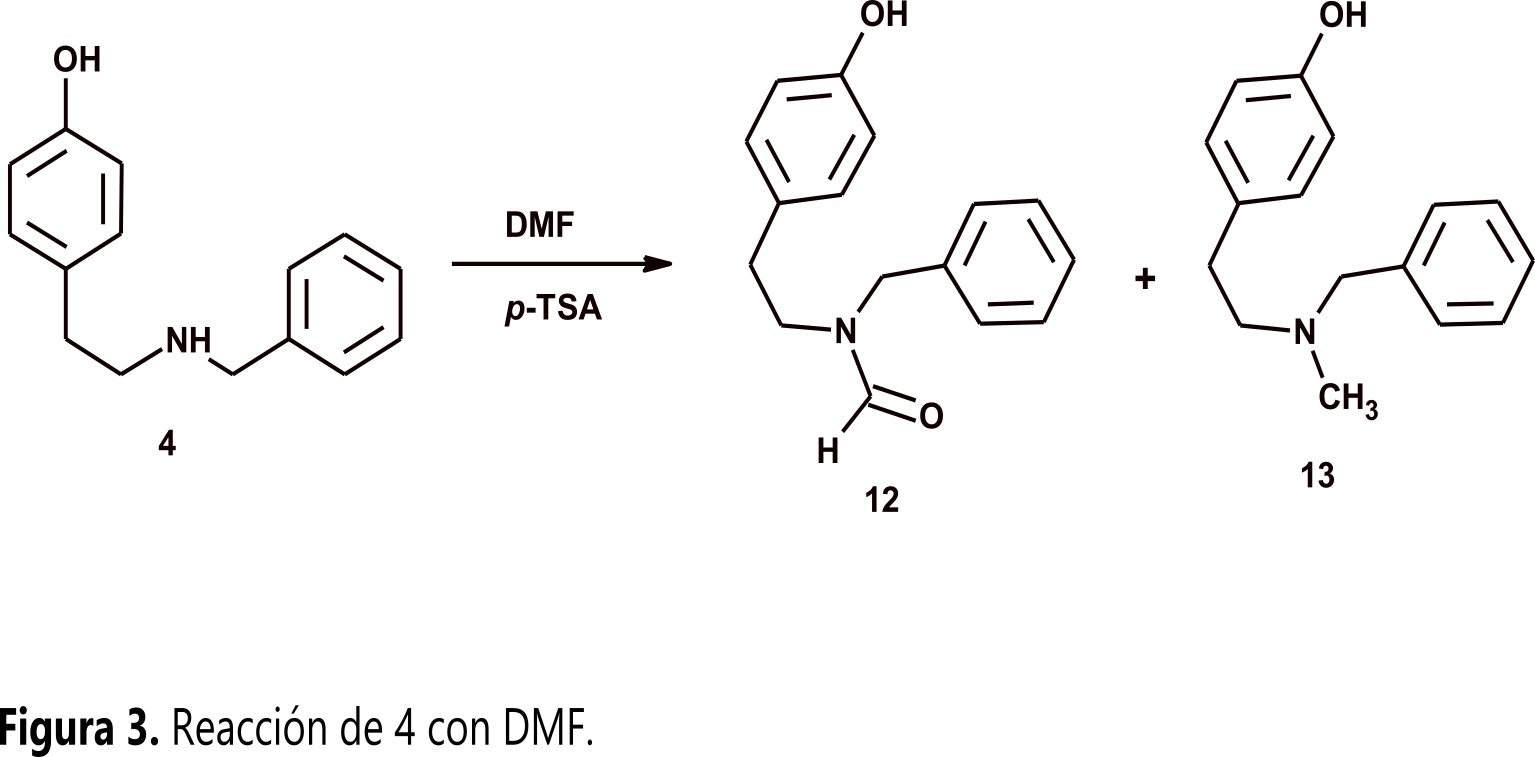
Considerando lo anterior surgió la pregunta: ¿una amina secundaria derivada de tiramina podrá reaccionar con aldehídos aromáticos? ( 12 , 13). Para obtener respuesta, se tomó como experimento modelo 4 y 3-nitrobenzaldehido (11) bajo diferentes condiciones experimentales. Los resultados mostraron que 4 no reacciona con 11 y solo fue posible obtener dos productos inesperados por reacción de 4 con el disolvente (Figura 3). En este artículo se presenta el análisis estructural de los productos obtenidos y se propone un mecanismo de reacción que permite racionalizar el curso de la reacción.
Materiales y métodos
General
Tiramina (Sigma-Aldrich, USA, grado síntesis) y los disolventes metanol, etanol y DMF (Merck, Alemania, grado analítico) se utilizaron sin purificación adicional. Los espectros de infrarrojo se adquirieron en un espectrofotómetro Nicolet iS 10 (Thermo Fisher Scientific, USA) empleando pastillas de KBr al 1% p/p. Los espectros de masas se registraron en un equipo Shimadzu LCMS-IT-TOF usando ionización por electrospray (ESI) en modo positivo. Las muestras se disolvieron en una mezcla acetonitrilo/agua/ácido fórmico 90:10:1 y se inyectaron directamente en el sistema. Los espectros de resonancia magnética nuclear se registraron en un espectrómetro Bruker Avance 400 operado a 400 MHz para 1H y 100 MHz para 13C empleando cloroformo o metanol deuterados (Merck, Alemania) como disolvente y tetrametilsilano (TMS) o la señal residual del disolvente como referencia. Los cálculos computacionales se realizaron empleando el programa Gaussian 03 (DFT-B3LYP/6-31G(d,p)).
Transamidación y transamidación-reducción de 4
Se sometió a calentamiento (130-135 °C) una mezcla de 4 (500 mg; 2,20 mmol) y TsOH monohidratado (80 mg; 0,42 mmol) disueltos en DMF. El curso de la reacción se monitoreó por CCD y cuando no se observó más cambio (96 h), se retiró la fuente de calor, se adicionó agua y se extrajo con CHCl3 (tres veces). La fase orgánica se lavó con agua (tres veces), se secó con NaSO4 anhidro y se retiró el disolvente a presión reducida. Del sólido obtenido se aislaron N-bencil-N-formiltiramina (12) y N-bencil-N-metiltiramina (13) por cromatografía en columna de silica gel eluyendo con mezclas CHCl3:AcOEt ( 14 ).
Resultados y discusión
Como se mencionó arriba, N-benciltiramina 4 empleando DMF como disolvente y TsOH como promotor, no reacciona con 3-nitrobenzaldehido 11 y solo se forman dos N-benciltiraminas N-sustituidas por reacción de 4 con el disolvente (Figura 3).
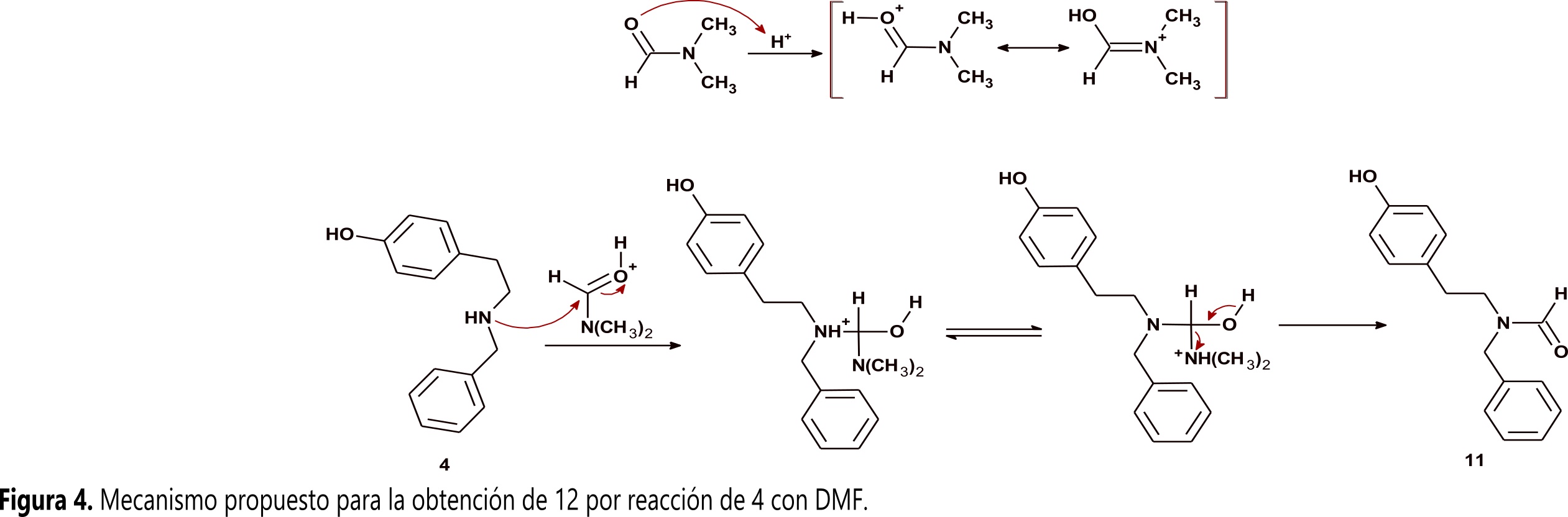
La primera de ellas corresponde a N-benciltiramina N-formilada (12) cuya formación se puede explicar por medio de una reacción de transamidación en la que el grupo amino de 4 realiza un ataque nucleofílico al grupo amido del DMF, este ataque lleva a una sustitución nucleofílica acílica como se muestra en la Figura 4.
N-bencil-N-formiltiramina (12)
Sólido rojo, C16H17NO2, rend. 20%, P.f. 116-119 °C. FT-IR (KBr) cm-1: 3370, 3068, 2925, 2854, 1704, 1615. RMN 1H (CDCl3): Rotámero Z (54%), d 7,83 (1H, s); 7,40-7,13 (5H, m); 6,91 (2H, d, J = 8,5 Hz); 6,74 (2H, d, J = 8,5 Hz); 4,56 (2H, s); 3,34 (2H, t, J = 7,4 Hz); 2,72 (2H, t, J = 6,5 Hz). Rotámero E (46 %), d 8,25 (1H, s); 7,40-7,13 (5H, m); 6,99 (2H, d, J = 8,5 Hz); 6,77 (2H, d, J = 8,5 Hz); 4,25 (2H, s); 3,44 (2H, t, J = 6,6 Hz); 2,70 (2H, t, J =6,5 Hz). RMN 13C (CDCl3): Rotámero Z, d 163,4; 155,4; 136,2; 129,9; 128,9; 128,8; 128,4; 128,2; 115,8; 48,8; 45,6; 33,8. Rotámero E d 163,2; 155,0; 135,8; 129,83; 129,79; 128,8; 127,8; 127,6; 115,5; 51,9; 43,9; 32,4. ESI-HRMS: m/z 256,1291 ([M+H]+, calculado 256,1332); 297,1512 ([M+CH3CN+H]+, calculado 297,1598) ( 14 ).
Los espectros de RMN (1H y 13C) del compuesto 12 muestran señales duplicadas para la mayoría de protones y carbonos. Como explicación para este comportamiento espectroscópico se propone la presencia de dos rotámeros que se encuentran en equilibrio en la solución. Esta presencia está favorecida por la alta barrera energética para la rotación del enlace CN en el grupo amida (carácter parcial de doble enlace).
Adicionalmente, el análisis espectroscópico permitió establecer que la señal que aparece a 8,25 ppm corresponde al rotámero E. En este rotámero el hidrógeno del grupo formilo se encuentra en el mismo plano del anillo bencílico y es desprotegido por efecto de anisotropía del anillo (Figura 5). Este efecto no está presente en el rotámero Z y por ello aparece a campo alto (7,83 ppm). La relación de integrales de los hidrógenos asignados a grupos formilo, d 7,83 y 8,25 ppm, permitió establecer que la mezcla de rotámeros se encuentra en proporción 54% (rotámero Z) a 46% (rotámero E). Cálculos computacionales también mostraron que el rotámero Z es la estructura de menor energía y se determinó una distribución de Boltzmann de 51% para el rotámero Z y de 49% para el rotámero E, confirmando lo observado con la relación de integrales en el espectro de RMN 1H.

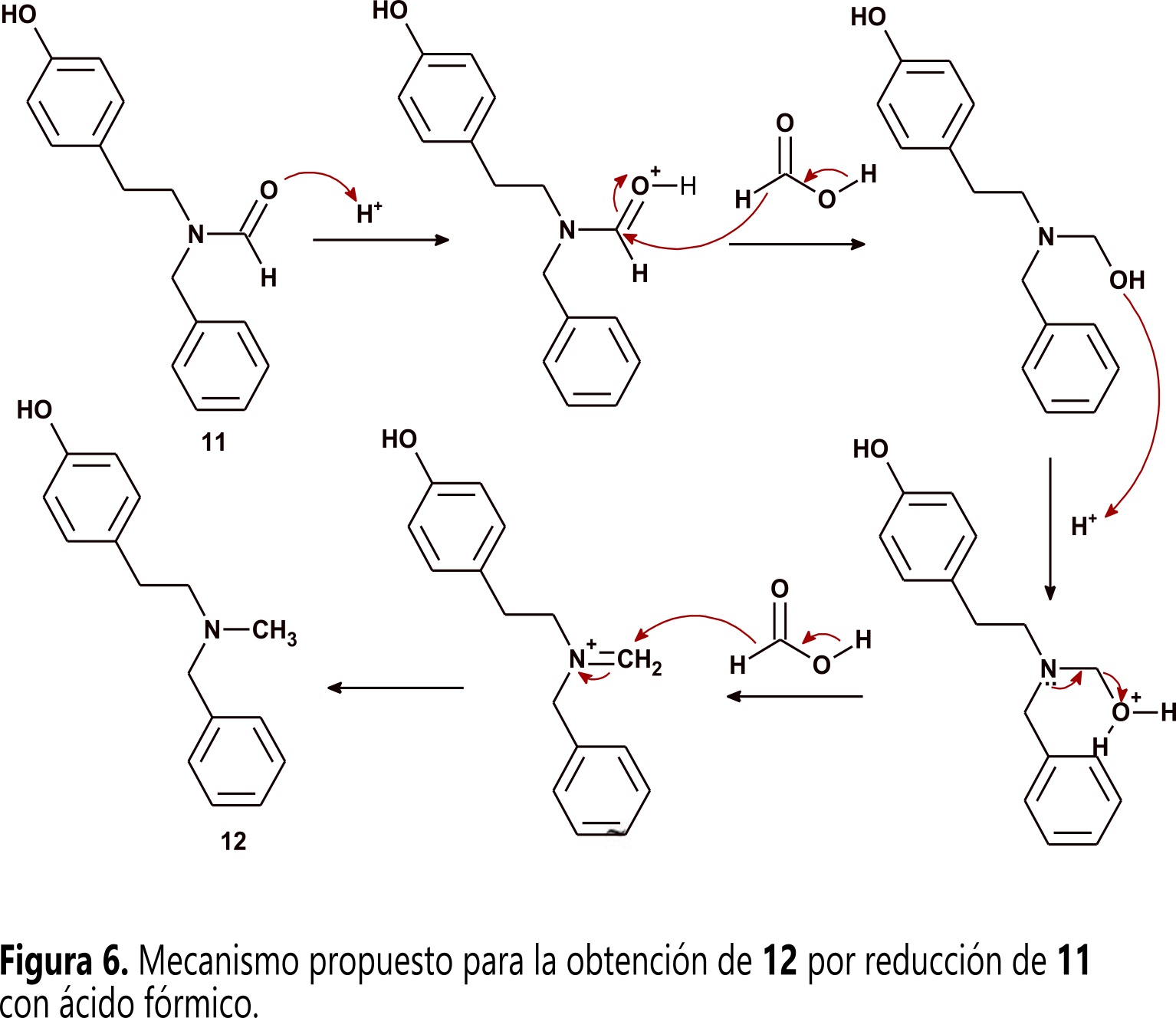
El segundo compuesto obtenido corresponde a N-benciltiramina metilada 13, su obtención muestra que adicional a la formilación ocurre una reducción del grupo formilo hasta metilo. Para determinar si el 3-nitrobenzaldehido 11 presente en el medio de reacción fue la especie que se comportó como donador de hidruro, se calentó 4 disuelta en DMF en presencia de TsOH, buscando reproducir las condiciones experimentales bajo las que se obtuvieron 12 y 13. Bajo estas condiciones, la reacción siguió el mismo curso y produjo nuevamente 12 y 13 demostrando que el aldehido 11 no tiene participación alguna en el curso de la reacción. Estos resultados permiten proponer que el agente donador de hidruro es ácido fórmico generado in situ por medio de hidrólisis ácida de DMF. Dicha hidrólisis ocurre por la presencia de agua proveniente tanto de humedad del disolvente como del TsOH monohidratado empleado como promotor de la transamidación. El ácido fórmico en el medio actúa como agente reductor de 12, siguiendo un mecanismo similar al propuesto para la aminación reductiva de Leuckart-Wallach (Figura 6) ( 15 , 16 ).

N-bencil-N-metiltiramina (13)
Sólido naranja, C16H19NO. Rend. 36%. P.f. 72-74 °C. FT-IR (KBr) cm-1: 3500-2500, 2949, 1637. RMN 1H (CD3OD): δ 7,37-7,30 (5H, m); 6,99 (2H, d, J = 8,5 Hz); 6,69 (2H, d, J = 8,5 Hz); 3,74 (2H, s); 2,82-2,68 (4H, m); 2,38 (3H, s). RMN 13C (CD3OD): δ 156,9; 136,0; 130,9; 130,6; 129,6; 129,5; 128,9; 116,3; 62,5; 60,0; 41,9; 32,9. ESI-HRMS: m/z 242,1507 ([M+H]+, calculado 242,1539) ( 14 ).
Estudios previos sobre la reactividad de feniletilaminas frente a compuestos carbonílicos han demostrado que el curso de reacción depende de efectos estéricos, electrónicos y de pre-organización molecular ( 17 ). Para el caso de 4, la pre-organización molecular previamente observada disminuye la nucleofilia del nitrógeno ( 11 ); los efectos estéricos por la presencia de dos sustituyentes voluminosos impiden la reacción con aldehídos aromáticos bajo las distintas condiciones de reacción empleadas. Cuando se utilizó DMF como disolvente, la elevada temperatura disminuyó los efectos de pre-organización molecular, el promotor ácido aumentó la electrofilia del disolvente y se disminuyeron los efectos estéricos. Lo anterior debido al bajo volumen que ocupa la DMF, lo que favoreció una reacción de transamidación del DMF que condujo a la formación del derivado formilado 12; la posterior reducción por ácido fórmico generado in situ permitió la formación de 13.
Conclusiones
La reacción de N-benciltiramina (4) con DMF conduce a la formación de N-bencil-N-formil-tiramina (12) y N-bencil-N-metiltiramina (13) por medio de reacciones de transamidación y de transamidación-reducción. Esta reacción está favorecida por las condiciones experimentales empleadas y por el tamaño de la DMF lo que disminuye efectos estéricos y de pre-organización molecular, efectos que usualmente controlan la reactividad y direccionalidad de las reacciones de feniletilaminas con compuestos carbonílicos.
Agradecimientos
Los autores agradecen a la División de Investigación sede Bogotá de la Universidad Nacional de Colombia por el soporte financiero (proyecto DIB No. 37398).
Referencias
1. Freeman, S.; Alder, J.F. Arylethylamine psychotropic recreational drugs: a chemical perspective. Eur. J. Med. Chem. 2002, 37, 527-539. DOI: https://doi.org/10.1016/S0223-5234(02)01382-X.
2. Bentley, K.W. β-Phenylethylamines and the isoquinoline alkaloids. Nat. Prod. Rep. 2006, 23, 444-463. DOI: https://doi.org/10.1039/B509523A.
3. Greene, S. L.; Kerr, F.; Braitberg, G. Review article: amphetamines and related drugs of abuse. Emerg. Med. Australas. 2008, 20, 391-402. DOI: https://doi.org/10.1111/j.1742-6723.2008.01114.x.
4. Sulzer, D.; Sonders, M. S.; Poulsen, N. W.; Galli, A. Mechanisms of neurotransmitter release by amphetamines: a review. Prog. Neurobiol. 2005, 75, 406-433. DOI: https://doi.org/10.1016/j.pneurobio.2005.04.003.
5. Quevedo, R.; Valderrama, K.; Moreno-Murillo, B.; Laverde, M.; Fajardo, V. A new bisbenzyltetrahydroisoquinoline alkaloid from Berberis tabiensis (Berberidaceae). Biochem. Syst. Ecol. 2008, 36, 812-814. DOI: https://doi.org/10.1016/j.bse.2008.07.007.
6. Quevedo, R.; Nuñez-Dallos, N.; Quiñones, M.L. Larvicidal activity of single and macrocyclic tyrosine derivatives against three important vector mosquitoes. Res. Chem. Intermed. 2015, 41, 5283-5292. DOI: https://doi.org/10.1007/s11164-014-1630-9.
7. Quevedo, R.; Baquero, E.; Rodriguez, M. Regioselectivity in isoquinoline alkaloid synthesis. Tetrahedron Lett. 2010, 51, 1774-1778. DOI: https://doi.org/10.1016/j.tetlet.2010.01.115.
8. Quevedo, R.; Nuñez-Dallos, N.; Wurst, K.; Duarte-Ruiz, A. A structural study of the intermolecular interactions of tyramine in the solid state and in solution. J. Mol. Struct. 2012, 1029, 175-179. DOI: https://doi.org/10.1016/j.molstruc.2012.07.013.
9. Quevedo, R.; Díaz-Oviedo, C.; Quevedo-Acosta, Y. Role of hydroxyl groups on the aromatic ring in the reactivity and selectivity of the reaction of β-phenylethylamines with non-enolizable aldehydes. Res. Chem. Intermed. 2015, 41, 98359843. DOI: https://doi.org/10.1007/s11164-015-1987-4.
10. Maldonado, M.; Pérez-Redondo, A.; Quevedo, R. Synthesis and intermolecular interactions of N-benzylidenetyramines. J. Mol. Struct. 2017, 1127, 689-693. DOI: https://doi.org/10.1016/j.molstruc.2016.08.035.
11. Díaz-Oviedo, C.; Quevedo, R. N-Benzylazacyclophane synthesis via aromatic Mannich reaction. Tetrahedron Lett. 2014, 55, 6571-6574. DOI: https://doi.org/10.1016/j.tetlet.2014.10.023.
12. Cimarelli, C.; Fratoni, D.; Mazzanti, A.; Palmieri, G. Betti Reaction of Cyclic Imines with Naphthols and Phenols Preparation of New Derivatives of Betti's Bases. Eur. J. Org. Chem. 2011, 2011, 2094-2100. DOI: https://doi.org/10.1002/ejoc.201001611.
13. Parvez, A.; Meshram, J.; Tiwari, V.; Sheik, J.; Dongre, R.; Youssoufi, M. H.; Hadda, T. B. Pharmacophores modeling in terms of prediction of theoretical physico-chemical properties and verification by experimental correlations of novel coumarin derivatives produced via Bettis protocol. E. J. med. Chem. 2010, 45, 4370-4378. DOI: https://doi.org/10.1016/j.ejmech.2010.06.004.
14. Díaz Oviedo, C. D. Estudio de la reacción entre β-(4-hidroxifenil) etilaminas y aldehídos no enolizables competencia entre las reacciones de Betti y de Pictet-Spengler, M.S. Thesis, Universidad Nacional de Colombia, 2014; pp. 45-96.
15. Muzart, J. N,N-dimethylformamide: much more than a solvent. Tetrahedron, 2009, 65, 8313-8323. DOI: https://doi.org/10.1016/j.tet.2009.06.091.
16. Lukasiewicz, A. A study of the mechanism of certain chemical reactions - I: The mechanism of the leuckart-wallach reaction and of the reduction of schiff bases by formic acid. Tetrahedron, 1963, 19, 1789-1799. DOI: https://doi.org/10.1016/S0040-4020(01)99253-1.
17. Quevedo, R. Influence of Steric, Electronic, and Molecular Preorganization Effects in the Reactivity of β‐phenylethylamines with Nonenolizable Aldehydes. In Non-covalent Interactions in the Synthesis and Design of New Compounds; Maharramov, A.; Mahmudov, K.; Kopylovich, M., Pombeiro, A., Ed.. Wiley: New York, USA, 2016; pp. 49-62. DOI: https://doi.org/10.1002/9781119113874.ch3.
Recibido: 10 de abril de 2017; Aceptado: 7 de junio de 2017
Resumen
La tiramina y la N-benciltiramina reaccionan con formaldehído para formar azaciclofanos por medio de condensaciones tipo Mannich aromáticas y reaccionan con aldehídos no enolizables para formar las respectivas bases de Schiff. En este artículo se presenta la síntesis inesperada de N-bencil-N-formiltiramina y N-bencil-N-metiltiramina por medio de reacciones de transamidación y de transamidación-reducción de N-benciltiramina con N,N-dimetilformamida. Para explicar el curso de la reacción se propuso un mecanismo que involucra la formilación de N-benciltiramina y posterior reducción de Leuckart-Wallach inducida por ácido fórmico generado in situ.
Palabras clave
carboxamida, dimetilformamida, Leuckart-Wallach, tiramina.Abstract
Tyramine and N-benzyltyramine react with formaldehyde to form azacyclophanes by means of aromatic Mannich reactions and react with non-enolizable aldehydes to form the respective Schiff bases. In this paper we present the unexpected synthesis of N-formyl-N-benzyltyramine and N-methyl-N-benzyltyramine by means of transamidation and transamidation-reduction of N-benzyltyramine with N,N-dimethylformamide. A reaction mechanism involving formylation of N-benzyltiramine followed by a Leuckart-Wallach reduction is proposed for rationalising such transformation.
Keywords
carboxamide, dimethylformamide, Leuckart-Wallach, tyramine.Resumo
A tiramina e a N-benziltiramina reagem com formaldeído para formar azaciclofanos por meio de reações de Mannich aromáticas e reagem com aldeídos não-enolizáveis para formar as respectivas bases de Schiff. Neste trabalho apresenta-se a síntese inesperada de N-formil-N-benziltiramina e N-metil-N-benziltiramina por meio de transamidação e transamidação-redução de N-benziltiramina promovida pela N,N-dimetilformamida. Propõe-se um mecanismo de reação que envolve a formilação de N-benziltiramina seguida por uma redução de Leuckart-Wallach induzida pelo ácido fórmico gerado in situ.
Palavras-chave
carboxamida, dimetilformamida, Leuckart-Wallach, tiramina.Introducción
Las β-feniletilaminas son conocidas por su actividad sobre el sistema nervioso central (neurotransmisores), por sus efectos psicotrópicos y por ser precursores en la síntesis y biosíntesis de moléculas de interés químico y biológico ( 1 - 7 ).
La tiramina (p-hidroxifeniletilamina) es una β-feniletilamina simpaticomimética que incrementa la presión arterial y estimula los músculos lisos. Este fármaco ha sido ampliamente usado en estudios sobre la fisiología y fisiopatología del sistema nervioso simpático y su influencia en el sistema cardiovascular ( 8 ).
La tiramina (1) reacciona con aldehídos aromáticos para formar las respectivas bases de Schiff (2) y con formaldehido para formar un azaciclofano pentacíclico (3) producto de una doble condensación tipo Mannich entre dos moléculas de tiramina y cuatro de formaldehído (Figura 1) ( 9 , 10 ).
N-benciltiramina (4) y (N-(4-metoxibencil)tiramina (5) reaccionan con formaldehído por medio de una reacción tipo Mannich para formar los respectivos azaciclofanos (6-7), mientras que (N-(3-nitrobencil)tiramina (8) produce una mezcla compleja cuyos productos mayoritarios son N-bencil-N-metiltiramina (9) y un dímero conformado por dos 4 unidas por un metileno con una de las benciltiraminas N-metilada (10) (Figura 2). La metilación en los productos 9 y 10 ocurre por medio de una reacción de Eschweiler–Clarke con ácido fórmico generado in situ (11).
Considerando lo anterior surgió la pregunta: ¿una amina secundaria derivada de tiramina podrá reaccionar con aldehídos aromáticos? ( 12 , 13). Para obtener respuesta, se tomó como experimento modelo 4 y 3-nitrobenzaldehido (11) bajo diferentes condiciones experimentales. Los resultados mostraron que 4 no reacciona con 11 y solo fue posible obtener dos productos inesperados por reacción de 4 con el disolvente (Figura 3). En este artículo se presenta el análisis estructural de los productos obtenidos y se propone un mecanismo de reacción que permite racionalizar el curso de la reacción.
Materiales y métodos
General
Tiramina (Sigma-Aldrich, USA, grado síntesis) y los disolventes metanol, etanol y DMF (Merck, Alemania, grado analítico) se utilizaron sin purificación adicional. Los espectros de infrarrojo se adquirieron en un espectrofotómetro Nicolet™ iS™ 10 (Thermo Fisher Scientific, USA) empleando pastillas de KBr al 1% p/p. Los espectros de masas se registraron en un equipo Shimadzu LCMS-IT-TOF usando ionización por electrospray (ESI) en modo positivo. Las muestras se disolvieron en una mezcla acetonitrilo/agua/ácido fórmico 90:10:1 y se inyectaron directamente en el sistema. Los espectros de resonancia magnética nuclear se registraron en un espectrómetro Bruker Avance™ 400 operado a 400 MHz para 1H y 100 MHz para 13C empleando cloroformo o metanol deuterados (Merck, Alemania) como disolvente y tetrametilsilano (TMS) o la señal residual del disolvente como referencia. Los cálculos computacionales se realizaron empleando el programa Gaussian 03 (DFT-B3LYP/6-31G(d,p)).
Transamidación y transamidación-reducción de 4
Se sometió a calentamiento (130-135 °C) una mezcla de 4 (500 mg; 2,20 mmol) y TsOH monohidratado (80 mg; 0,42 mmol) disueltos en DMF. El curso de la reacción se monitoreó por CCD y cuando no se observó más cambio (96 h), se retiró la fuente de calor, se adicionó agua y se extrajo con CHCl3 (tres veces). La fase orgánica se lavó con agua (tres veces), se secó con NaSO4 anhidro y se retiró el disolvente a presión reducida. Del sólido obtenido se aislaron N-bencil-N-formiltiramina (12) y N-bencil-N-metiltiramina (13) por cromatografía en columna de silica gel eluyendo con mezclas CHCl3:AcOEt ( 14 ).
Resultados y discusión
Como se mencionó arriba, N-benciltiramina 4 empleando DMF como disolvente y TsOH como promotor, no reacciona con 3-nitrobenzaldehido 11 y solo se forman dos N-benciltiraminas N-sustituidas por reacción de 4 con el disolvente (Figura 3).
La primera de ellas corresponde a N-benciltiramina N-formilada (12) cuya formación se puede explicar por medio de una reacción de transamidación en la que el grupo amino de 4 realiza un ataque nucleofílico al grupo amido del DMF, este ataque lleva a una sustitución nucleofílica acílica como se muestra en la Figura 4.
N-bencil-N-formiltiramina (12)
Sólido rojo, C16H17NO2, rend. 20%, P.f. 116-119 °C. FT-IR (KBr) cm-1: 3370, 3068, 2925, 2854, 1704, 1615. RMN 1H (CDCl3): Rotámero Z (54%), d 7,83 (1H, s); 7,40-7,13 (5H, m); 6,91 (2H, d, J = 8,5 Hz); 6,74 (2H, d, J = 8,5 Hz); 4,56 (2H, s); 3,34 (2H, t, J = 7,4 Hz); 2,72 (2H, t, J = 6,5 Hz). Rotámero E (46 %), d 8,25 (1H, s); 7,40-7,13 (5H, m); 6,99 (2H, d, J = 8,5 Hz); 6,77 (2H, d, J = 8,5 Hz); 4,25 (2H, s); 3,44 (2H, t, J = 6,6 Hz); 2,70 (2H, t, J =6,5 Hz). RMN 13C (CDCl3): Rotámero Z, d 163,4; 155,4; 136,2; 129,9; 128,9; 128,8; 128,4; 128,2; 115,8; 48,8; 45,6; 33,8. Rotámero E d 163,2; 155,0; 135,8; 129,83; 129,79; 128,8; 127,8; 127,6; 115,5; 51,9; 43,9; 32,4. ESI-HRMS: m/z 256,1291 ([M+H]+, calculado 256,1332); 297,1512 ([M+CH3CN+H]+, calculado 297,1598) ( 14 ).
Los espectros de RMN (1H y 13C) del compuesto 12 muestran señales duplicadas para la mayoría de protones y carbonos. Como explicación para este comportamiento espectroscópico se propone la presencia de dos rotámeros que se encuentran en equilibrio en la solución. Esta presencia está favorecida por la alta barrera energética para la rotación del enlace C–N en el grupo amida (carácter parcial de doble enlace).
Adicionalmente, el análisis espectroscópico permitió establecer que la señal que aparece a 8,25 ppm corresponde al rotámero E. En este rotámero el hidrógeno del grupo formilo se encuentra en el mismo plano del anillo bencílico y es desprotegido por efecto de anisotropía del anillo (Figura 5). Este efecto no está presente en el rotámero Z y por ello aparece a campo alto (7,83 ppm). La relación de integrales de los hidrógenos asignados a grupos formilo, d 7,83 y 8,25 ppm, permitió establecer que la mezcla de rotámeros se encuentra en proporción 54% (rotámero Z) a 46% (rotámero E). Cálculos computacionales también mostraron que el rotámero Z es la estructura de menor energía y se determinó una distribución de Boltzmann de 51% para el rotámero Z y de 49% para el rotámero E, confirmando lo observado con la relación de integrales en el espectro de RMN 1H.
El segundo compuesto obtenido corresponde a N-benciltiramina metilada 13, su obtención muestra que adicional a la formilación ocurre una reducción del grupo formilo hasta metilo. Para determinar si el 3-nitrobenzaldehido 11 presente en el medio de reacción fue la especie que se comportó como donador de hidruro, se calentó 4 disuelta en DMF en presencia de TsOH, buscando reproducir las condiciones experimentales bajo las que se obtuvieron 12 y 13. Bajo estas condiciones, la reacción siguió el mismo curso y produjo nuevamente 12 y 13 demostrando que el aldehido 11 no tiene participación alguna en el curso de la reacción. Estos resultados permiten proponer que el agente donador de hidruro es ácido fórmico generado in situ por medio de hidrólisis ácida de DMF. Dicha hidrólisis ocurre por la presencia de agua proveniente tanto de humedad del disolvente como del TsOH monohidratado empleado como promotor de la transamidación. El ácido fórmico en el medio actúa como agente reductor de 12, siguiendo un mecanismo similar al propuesto para la aminación reductiva de Leuckart-Wallach (Figura 6) ( 15 , 16 ).
N-bencil-N-metiltiramina (13)
Sólido naranja, C16H19NO. Rend. 36%. P.f. 72-74 °C. FT-IR (KBr) cm-1: 3500-2500, 2949, 1637. RMN 1H (CD3OD): δ 7,37-7,30 (5H, m); 6,99 (2H, d, J = 8,5 Hz); 6,69 (2H, d, J = 8,5 Hz); 3,74 (2H, s); 2,82-2,68 (4H, m); 2,38 (3H, s). RMN 13C (CD3OD): δ 156,9; 136,0; 130,9; 130,6; 129,6; 129,5; 128,9; 116,3; 62,5; 60,0; 41,9; 32,9. ESI-HRMS: m/z 242,1507 ([M+H]+, calculado 242,1539) ( 14 ).
Estudios previos sobre la reactividad de feniletilaminas frente a compuestos carbonílicos han demostrado que el curso de reacción depende de efectos estéricos, electrónicos y de pre-organización molecular ( 17 ). Para el caso de 4, la pre-organización molecular previamente observada disminuye la nucleofilia del nitrógeno ( 11 ); los efectos estéricos por la presencia de dos sustituyentes voluminosos impiden la reacción con aldehídos aromáticos bajo las distintas condiciones de reacción empleadas. Cuando se utilizó DMF como disolvente, la elevada temperatura disminuyó los efectos de pre-organización molecular, el promotor ácido aumentó la electrofilia del disolvente y se disminuyeron los efectos estéricos. Lo anterior debido al bajo volumen que ocupa la DMF, lo que favoreció una reacción de transamidación del DMF que condujo a la formación del derivado formilado 12; la posterior reducción por ácido fórmico generado in situ permitió la formación de 13.
Conclusiones
La reacción de N-benciltiramina (4) con DMF conduce a la formación de N-bencil-N-formil-tiramina (12) y N-bencil-N-metiltiramina (13) por medio de reacciones de transamidación y de transamidación-reducción. Esta reacción está favorecida por las condiciones experimentales empleadas y por el tamaño de la DMF lo que disminuye efectos estéricos y de pre-organización molecular, efectos que usualmente controlan la reactividad y direccionalidad de las reacciones de feniletilaminas con compuestos carbonílicos.
Agradecimientos
Los autores agradecen a la División de Investigación sede Bogotá de la Universidad Nacional de Colombia por el soporte financiero (proyecto DIB No. 37398).
Referencias
Referencias
Freeman, S.; Alder, J.F. Arylethylamine psychotropic recreational drugs: a chemical perspective. Eur. J. Med. Chem. 2002, 37, 527-539. DOI: https://doi.org/10.1016/S0223-5234(02)01382-X.
Bentley, K.W. β-Phenylethylamines and the isoquinoline alkaloids. Nat. Prod. Rep. 2006, 23, 444-463. DOI: https://doi.org/10.1039/B509523A.
Greene, S. L.; Kerr, F.; Braitberg, G. Review article: amphetamines and related drugs of abuse. Emerg. Med. Australas. 2008, 20, 391-402. DOI: https://doi.org/10.1111/j.1742-6723.2008.01114.x.
Sulzer, D.; Sonders, M. S.; Poulsen, N. W.; Galli, A. Mechanisms of neurotransmitter release by amphetamines: a review. Prog. Neurobiol. 2005, 75, 406-433. DOI: https://doi.org/10.1016/j.pneurobio.2005.04.003.
Quevedo, R.; Valderrama, K.; Moreno-Murillo, B.; Laverde, M.; Fajardo, V. A new bisbenzyltetrahydroisoquinoline alkaloid from Berberis tabiensis (Berberidaceae). Biochem. Syst. Ecol. 2008, 36, 812-814. DOI: https://doi.org/10.1016/j.bse.2008.07.007.
Quevedo, R.; Nuñez-Dallos, N.; Quiñones, M.L. Larvicidal activity of single and macrocyclic tyrosine derivatives against three important vector mosquitoes. Res. Chem. Intermed. 2015, 41, 5283-5292. DOI: https://doi.org/10.1007/s11164-014-1630-9.
Quevedo, R.; Baquero, E.; Rodriguez, M. Regioselectivity in isoquinoline alkaloid synthesis. Tetrahedron Lett. 2010, 51, 1774-1778. DOI: https://doi.org/10.1016/j.tetlet.2010.01.115.
Quevedo, R.; Nuñez-Dallos, N.; Wurst, K.; Duarte-Ruiz, A. A structural study of the intermolecular interactions of tyramine in the solid state and in solution. J. Mol. Struct. 2012, 1029, 175-179. DOI: https://doi.org/10.1016/j.molstruc.2012.07.013.
Quevedo, R.; Díaz-Oviedo, C.; Quevedo-Acosta, Y. Role of hydroxyl groups on the aromatic ring in the reactivity and selectivity of the reaction of β-phenylethylamines with non-enolizable aldehydes. Res. Chem. Intermed. 2015, 41, 9835–9843. DOI: https://doi.org/10.1007/s11164-015-1987-4.
Maldonado, M.; Pérez-Redondo, A.; Quevedo, R. Synthesis and intermolecular interactions of N-benzylidenetyramines. J. Mol. Struct. 2017, 1127, 689-693. DOI: https://doi.org/10.1016/j.molstruc.2016.08.035.
Díaz-Oviedo, C.; Quevedo, R. N-Benzylazacyclophane synthesis via aromatic Mannich reaction. Tetrahedron Lett. 2014, 55, 6571-6574. DOI: https://doi.org/10.1016/j.tetlet.2014.10.023.
Cimarelli, C.; Fratoni, D.; Mazzanti, A.; Palmieri, G. Betti Reaction of Cyclic Imines with Naphthols and Phenols – Preparation of New Derivatives of Betti's Bases. Eur. J. Org. Chem. 2011, 2011, 2094-2100. DOI: https://doi.org/10.1002/ejoc.201001611.
Parvez, A.; Meshram, J.; Tiwari, V.; Sheik, J.; Dongre, R.; Youssoufi, M. H.; Hadda, T. B. Pharmacophores modeling in terms of prediction of theoretical physico-chemical properties and verification by experimental correlations of novel coumarin derivatives produced via Betti’s protocol. E. J. med. Chem. 2010, 45, 4370-4378. DOI: https://doi.org/10.1016/j.ejmech.2010.06.004.
Díaz Oviedo, C. D. Estudio de la reacción entre β-(4-hidroxifenil) etilaminas y aldehídos no enolizables competencia entre las reacciones de Betti y de Pictet-Spengler, M.S. Thesis, Universidad Nacional de Colombia, 2014; pp. 45-96.
Muzart, J. N,N-dimethylformamide: much more than a solvent. Tetrahedron, 2009, 65, 8313-8323. DOI: https://doi.org/10.1016/j.tet.2009.06.091.
Lukasiewicz, A. A study of the mechanism of certain chemical reactions - I: The mechanism of the leuckart-wallach reaction and of the reduction of schiff bases by formic acid. Tetrahedron, 1963, 19, 1789-1799. DOI: https://doi.org/10.1016/S0040-4020(01)99253-1.
Quevedo, R. Influence of Steric, Electronic, and Molecular Preorganization Effects in the Reactivity of β‐phenylethylamines with Nonenolizable Aldehydes. In Non-covalent Interactions in the Synthesis and Design of New Compounds; Maharramov, A.; Mahmudov, K.; Kopylovich, M., Pombeiro, A., Ed.. Wiley: New York, USA, 2016; pp. 49-62. DOI: https://doi.org/10.1002/9781119113874.ch3.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Laura F. Leal, Sebastián Chaves, Rodolfo Quevedo. (2023). Synthesis and structural analysis of an asymmetric azacyclophane via Mannich cross macrocyclisation of -tyrosine derivatives. Results in Chemistry, 5, p.100684. https://doi.org/10.1016/j.rechem.2022.100684.
2. Andrés Gonzalez‐Oñate, Jorge Alí‐Torres, Rodolfo Quevedo. (2024). Hydrogen Bond‐Assisted Macrocyclic Synthesis: An Extended Application For 4‐Hydroxybenzylamine Derivatives. ChemistrySelect, 9(34) https://doi.org/10.1002/slct.202402715.
3. Andrés Gonzalez-Oñate, Jorge Alí-Torres, Rodolfo Quevedo. (2024). The role of non-covalent interactions in 4-hydroxybenzylamine macrocyclisation: computational and synthetic evidence. RSC Advances, 14(6), p.3691. https://doi.org/10.1039/D3RA08508B.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2018 Revista Colombiana de Química

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).