Síntesis y caracterización estructural de hidrotalcitas de Cu-Zn-Al
Synthesis and structural characterization of Zn-Al-Cu hydrotalcites
DOI:
https://doi.org/10.15446/rev.colomb.quim.v45n3.61381Palabras clave:
hidrotalcitas, cobre, colapso de estructura (es)Hydrotalcite, copper, collapse of structure (en)
Las hidrotalcitas pueden ser usadas en áreas como catálisis, medicina, química ambiental, entre otras. Dependiendo de los metales presentes, los sólidos derivados de la calcinación de hidrotalcitas también son usados debido a su carácter básico, efecto de memoria y alta área superficial especifica. En este estudio se evaluaron características de hidrotalcitas a base de Cu-Zn-Al. Los análisis se realizaron usando AAS, DRX, FTIR, TGA y DSC. Se observó que, en los sólidos con mayor cantidad de cobre, la banda del estiramiento O••H (M••OH, H••OH) se desplaza a valores más bajos de número de onda, debido a que la densidad electrónica de los grupos OH se orienta hacia el centro metálico de cobre. En todos los sólidos se observó la formación de la fase hidrotalcita, y de la fase Cu(OH)2 en los sólidos con mayor contenido de cobre, lo que puede ser atribuido al efecto Jahn-Teller. Los resultados mostraron que los sólidos con mayor contenido de cobre colapsan en temperaturas menores. En todas las muestras se observaron eventos como: descomposición de la estructura HTLc, formación de óxidos metálicos y descomposición de carbonatos que quedaron ocluidos en los poros de los sólidos debido al colapso de la estructura laminar.
Doi: https://doi.org/10.15446/rev.colomb.quim.v45n3.61381.
Síntesis y caracterización estructural de hidrotalcitas de Cu-Zn-Al
Synthesis and structural characterization of Zn-Al-Cu hydrotalcites
Síntese e caracterização estrutural de hidrotalcitas de Cu-Zn-Al
Johana Rodríguez Ruiz1, Adolfo Pájaro Payares1,2, Edgardo Meza Fuentes2,*
1 Grupo de Investigación en Procesos de la Industria Petroquímica. SENA-centro para la Industria Petroquímica, Cartagena, Bolívar, Colombia
2 Grupo de Estudios en Materiales y Combustibles, Programa de Química, Universidad de Cartagena, Cartagena, Colombia.
* Autor para correspondencia: emezaf@unicartagena.edu.co
Article citation:
Rodríguez-Ruiz, J.; Pájaro-Payares, A.; Meza-Fuentes, E. Síntesis y caracterización estructural de hidrotalcitas de Cu-Zn-Al Rev. Colomb. Quim. 2016, 45 (3), 33-38. DOI: https://doi.org/10.15446/rev.colomb.quim.v45n3.61381.
Recibido: 15 de Junio de 2016. Aceptado: 9 de Septiembre de 2016.
Resumen
Las hidrotalcitas pueden ser usadas en áreas como catálisis, medicina, química ambiental, entre otras. Dependiendo de los metales presentes, los sólidos derivados de la calcinación de hidrotalcitas también son usados debido a su carácter básico, efecto de memoria y alta área superficial especifica. En este estudio se describen algunas características de hidrotalcitas a base de Cu-Zn-Al. Los análisis se realizaron usando AAS, DRX, FTIR, TGA y DSC. En el espectro FTIR se observó que, en los sólidos con mayor cantidad de cobre, la banda del estiramiento O••H (M••OH, H••OH) se desplazó a valores más bajos de número de onda, debido a que la densidad electrónica de los grupos OH se orienta hacia el centro metálico de cobre. En todos los sólidos se observó la formación de la fase hidrotalcita, y de la fase Cu(OH)) en los sólidos con mayor contenido de cobre, lo que puede ser atribuido al efecto Jahn-Teller. Los resultados mostraron que los sólidos con mayor contenidode cobre colapsan en temperaturas menores. En todas las muestras se observaron eventos como:descomposición de la estructura HTLc, formación de óxidos metálicos y descomposición decarbonatos que quedaron ocluidos en los poros de los sólidos debido al colapso de la estructuralaminar.
Palabras clave: Hidrotalcitas, cobre, colapso de estructura.
Abstract
Hydrotalcite-like compounds have been used in catalysis, medicine, environmental chemistry, and other applications. Depending on the metals present, the solids obtained by calcination can be used due to their basicity, memory effect, and high specific surface area. This study describes some characteristics of hydrotalcites based on Cu-Zn-Al. The solids were characterized by AAS, XRD, FTIR, DSC and TGA. In the FTIR spectra it was observed that in the solids with higher copper contents the band signed to O••H stretching (M••OH, H••OH) was moved to lower wave number values, because electron density of hydroxide groups orients toward the metallic copper center. In all materials hydrotalcite phase formation was observed and the Cu(OH)) phase in solids with higher copper content was detected, fact attributed to the Jahn-Teller effect. Results indicate that the collapse of the structure occurs at lower temperatures in the case of solids with higher copper content. In all the tested materials the decomposition of the HTLc structure and the formation ofmetal oxides was observed, as well as decomposition of carbonate ions occluded in the solid dueto the collapse of the lamellar structure.
Palabras clave: Hydrotalcite, copper, collapse of structure.
Resumo
Os compostos do tipo hidrotalcita podem ser usados nas áreas de catalise, medicina, química ambiental, entre outras. Dependendo dos metais presentes, os sólidos obtidos pela calcinação de hidrotalcitas também podem ser usados devido a propriedades tais como: caráter básico, efeito de memória e elevada área superficial especifica. Neste estudo descrevem-se algumas características das hidrotalcitas baseadas em Cu-Zn-Al. Na caracterização dos sólidos usaram-se astécnicas AAS, DRX, FTIR, TGA e DSC. Observou-se nos sólidos com maior conteúdo de cobre que o estiramento O••H (M••OH, H••OH) se desloca a valores menores de numero de onda, devido a que a densidade eletrônica dos grupos hidróxido se orienta em direção ao centro metálico de cobre. Em todos os materiais observou-se a fase hidrotalcita e nos sólidos com maior conteúdo de cobre foi detectada a fase Cu(OH)), fato atribuído ao efeito Jahn-Teller. Os resultados indicam que o colapso da estrutura acontece em temperaturas menores no caso dos sólidos com maior conteúdo de cobre. Em todos os materiais observaram-se decomposição da estrutura HTLc, formação de óxidosúmetálicos, e a decomposição dos íons carbonato que ficaram ocluídos nos sólidos devido ao colapsoda estrutura lamelar.
Palavras-Chave: Hidrotalcitas, cobre, colapso da estrutura.
Introducción
Los hidróxidos dobles laminares (HDLs) o compuestos del tipo hidrotalcita (HTLc) pertenecen al tipo de arcillas amónicas que poseen una estructura representada por la siguiente fórmula:
Donde M(II) y M(III) corresponden a metales con cargas 2+ y 3+, respectivamente; el término Anx/n corresponde a la presencia de un anión que estabiliza la carga positiva, generada por la incorporación del metal en estado de oxidación 3+ en la red de un hidróxido de un metal divalente (1, 2).
El término hidrotalcita (HTLc) corresponde al compuesto con la fórmula general Mg6A12(OH)16CO3•H2O, donde la fracción atómica del Al3+ corresponde a 0,25 y la del Mg2+ a 0,75 de los metales presentes (1). La estructura de las hidrotalcitas se fundamenta en la brucita [Mg(OH)2] que posee una geometría laminar de alta simetría, donde el catión Mg2+ está situado en el centro de un octaedro y coordinado a seis grupos OH. En este compuesto los octaedros comparten los lados formando láminas planas e infinitas que se apilan unas sobre otras y que se mantienen unidas a través de interacciones de tipo puente de hidrógeno (2, 3).
Cuando en la estructura de la brucita los iones Mg2+ son sustituidos por iones trivalentes con radios atómicos similares al del magnesio, se generan cargas positivas a lo largo de las láminas, las cuales deben ser compensadas con la presencia de aniones que se incorporan en los espacios existentes entre una lámina y otra. Sin embargo, debido a que los aniones no ocupan todo el espacio entre las láminas, quedan espacios libres en los que se depositan moléculas de agua (4, 5).
Los cationes M2+ más estudiados en la literatura son Mg2+, Fe2+, Ni2+, Co2+, Zn2+ y Cu2+, mientras que los cationes M3+ más comunes son Al3+, Cr3+ y Fe3+, pudiendo ser usados todos los cationescon radios iónicos entre 0,5 e 0,8 Å (1, 5). Las hidrotalcitas no se limitan a poseer en su estructura solo un catión divalente y otro trivalente, ya que estas cantidades pueden variar siempre y cuando la suma de los iones divalentes y trivalentes esté en el límite de los valores de x necesarios para que ocurra la formación de la estructura. En este contexto se han sintetizado hidrotalcitas que contienen cobre y zinc (6, 7), cobre y cobalto (8), níquel y zinc (7) y otras combinaciones (1).
Las hidrotalcitas están constituidas por celdas unitarias ortorrómbicas con una simetría R-3m y un valor del parámetro c, que es tres veces la distancia entre dos láminas sucesivas. El parámetro de celda c es determinado por el tamaño y por la cantidad de aniones presentes entre las láminas, mientras que el parámetro de celda a, depende del tipo y de la cantidad de los cationes presentes (2). En cuanto a los aniones, el más estudiado es el carbonato, debido a su estabilidad y a que se descompone en dióxido de carbono por efecto de la temperatura. Otros aniones empleados en la síntesis de hidrotalcita son: F-, C1-, Br-, I-, (C1O4)-, (NO3)-, (CIO3)-, (IO3)-, OH-, (CrO4)2- (1, 2), así como polioxometalatos y aniones orgánicos (9).
Debido a las propiedades químicas de las hidrotalcitas, estas pueden dar origen a una gran variedad de productos a través de tratamientos térmicos que permiten obtener óxidos mixtos o mezclas de óxidos con propiedades que permiten diferentes propósitos: elevada área superficial específica, buena estabilidad térmica, alta dispersión y carácter básico. Estas propiedades han conducido a que dichos materiales hayan recibido mucha atención y aplicación en diversas áreas. En medicina, por ejemplo, las hidrotalcitas pueden ser utilizadas como agentes en el tratamiento de úlceras pépticas a través de la adsorción de la pepsina cargada negativamente dentro de las superficies cargadas positivamente. A nivel industrial se usan como componentes en los materiales de PVC, lo que permite que se conserve la fuerza y blancura del PVC durante más tiempo (10).
Las hidrotalcitas también son potencialmente útiles como catalizadores o precursores de catalizadores, ya que se pueden usar para formar óxidos metálicos mixtos con altas áreas superficiales y con un carácter básico que las hace útiles en varias reacciones. Algunos ejemplos del uso de hidrotalcitas del tipo Mg-Al para la generación de catalizadores activos y selectivos son la hidrogenación de metil-benzoato a benzaldehído, la reducción de aldehídos a alcoholes y la fotodegradación de compuestos fenólicos por medio de alquilaciones de fenol con 1-propanol y 2-propano. Del mismo modo, se han utilizado catalizadores a base de níquel y cobre, obtenidos apartir de precursores del tipo hidrotalcita en reacciones de reforma de metano y de alcoholes (6, 11-13) y reacción de desplazamiento de vapor de agua (7, 14), entre otras.
Este estudio se centra en las características de hidrotalcitas a base de cobre, zinc y aluminio en la obtención de catalizadores para reacciones de purificación y aumento de la producción de hidrógeno, a través de la reacción WGS (7) y reforma de metanol (15). Los resultados revelaron la formación de la estructura del tipo hidrotalcita en todos los materiales. También se observó que la composición de los materiales puede contribuir con la estabilidad térmica y con la formación de una o dos fases en los sólidos, notándose que en los materiales con mayor contenido de cobre elefecto Jahn-Teller conduce a la formación de partículas de hidróxido de cobre (II).
Materiales y métodos
Preparación de los materiales
Se prepararon los precursores de los catalizadores con estructura del tipo hidrotalcita (HTLc) por el método sal-base a pH constante (1). Para la síntesis de los precursores se mezcló una solución salina que contenía nitrato de cobre (Cu(NO3)2•6H2O) de grado analítico (marca Merck), nitrato de zinc (Zn(NO3)2•6H2O) de grado analítico (marca Merck) y nitrato de aluminio (Al(NO3)3•9H2O) de grado analítico (marca Merck) con una segunda solución que contenía hidróxido de potasio (KOH) de grado analítico (marca Vetec) y carbonato de potasio (K2CO3) de grado analítico (marca Vetec), manteniendo el pH a 8,3 y bajo agitación durante 2 h a 65 °C. El sólido formado se separó por filtración al vacío y se lavó con agua desionizada hasta la eliminación total de la especie nitrato; el material resultante se secó a 60 °C durante 24 h. Las muestras obtenidas fueron codificadas deacuerdo al número de moles de los metales presentes en cada sólido presentados en la Tabla 1.
Caracterización de los materiales
Los sólidos sintetizados fueron caracterizados usando espectroscopia de absorción atómica (AAS), espectroscopia en la región del infrarrojo medio con transformada de Fourier (FTIR), análisis termogravimétrico (TGA), calorimetria diferencial de barrido (DSC) y difracción de rayos X (DRX). La determinación del contenido de los metales por (AAS) en los sólidos sintetizados se realizó en un equipo Unicam Modelo Solaar 969, previa disolución de los sólidos en medio ácido.
Los DRX de los sólidos del tipo hidrotalcita fueron obtenidos en un equipo BRUKER modelo D8 ADVANCE, usando radiación CuKai, generada a 4o kV y 3o mA, en el intervalo de medición de io-8o° 26 usando un paso de o,o2 °/s.
Los análisis FTIR fueron realizados en un equipo Shimadzu modelo IRAffinity, en la región entre 4ooo y 4oo cm-i. Para estos análisis las muestras fueron dispersadas en bromuro de potasio en una relación isioo y después prensadas en pastillas que fueron analizadas en la región de número de onda antes mencionada.
Los análisis de TGA y DSC fueron realizados en un equipo TA Instruments Modelo SDT Q6oo, en el intervalo de temperaturas de 3o a iooo °C en un flujo de aire de 5o mL/min y una velocidad de calentamiento de io °C/min.
Resultados y discusión
Las relaciones molares y los códigos usados para identificar los sólidos sintetizados son mostrados en la Tabla 1. Las relaciones molares obtenidas a trav s espectrometria de absorción atómica muestran un alto grado de correspondencia entre los valores teóricos (Cu/Zn = 2,o o i,o; Cu/Al = i,5 o i,33) y los obtenidos experimentalmente, lo cual comprueba la efectividad del método de síntesis.
Los gráficos de difracción de rayos X (Figura 1) confirman la presencia de la estructura hidrotalcita en todos los sólidos. Sin embargo, en los materiales con menor contenido de aluminio se observaron señales que indican la formación de algunas partículas de hidróxido de cobre [Cu(OH)2]. Esto puede atribuirse al efecto Jahn-Teller que presentan los compuestos de Cu(II), donde ocurre una distorsión de la simetria octaédrica que conduce a la estabilización de los compuestos, afectando la formación de la fase hidrotalcitas en estos materiales (15).
En este sentido, se observa que el aumento del metal trivalente ayuda a estabilizar la estructura del tipo hidrotalcita, debido al distanciamiento de las unidades de Cu(OH)2, disminuyendo asi el efecto Jahn-Teller.
El sólido Cu033Zn033Al033 presentó el difractograma con los picos correspondientes a la estructura HTLc más estrechos y simétricos, lo que indica que en este material la presencia de mayor cantidad de zinc y de aluminio permite tener un material en el cual los átomos de cobre están menos próximos entre si, disminuyendo la posibilidad de ocurrencia del efecto Jahn-Teller, lo cual favoreció la formación de la fase hidrotalcita. Lo anterior se verifica a través del mayor tamaño de partícula (Dp) de la fase de la estructura HTLc de este material (Tabla 1). En los otros materiales el menor tamaño de las particulas es atribuido a la presencia de la fase Cu(OH)2 que puede actuar como una barrera entre las particulas de la estructura HTLc, disminuyendo su tamaño.
En relación al parámetro de celda c (Tabla 1), los valores no mostraron una tendencia asociada al aumento del anión carbonato en la estructura, lo que puede ser asociado a la presencia de particulas de hidróxido de cobre, las cuales pueden estar presentes tanto en la superficie de los sólidos, como en las regiones interlaminares. En el caso del parámetro de celda a, los materiales con más contenido de zinc presentaron mayores valores, debido a que este elemento posee mayor radio atómico (0,74 Å) que el cobre (0,72 Å).
Los espectros FTIR de los sólidos muestran varias bandas que son características de las estructuras HTLc que contienen el anión carbonato (Figura 2). Se observa que, en los sólidos con las cantidades más altas de cobre la banda originada por el estiramiento O-H (M-OH, H-OH) se desplaza ligeramente hacia valores más bajos de número de onda. Esto se debe a que la densidad electrónica del grupo OH se orienta hacia el centro metálico de cobre por su baja densidad electrónica en el orbital 4s (3d10 4s1), lo que conduce a la disminución de la frecuencia de vibración O-H en relación a otros elementos de la primera serie de transición (16).
En todos los sólidos se observó una banda a 1525 cm-1, característica de los iones carbonato, que está relacionada con el modo vibracional resultante de la disminución de la simetría D31l de los iones carbonato hacia la simetría C2v, debido a la interacción de este anión con los grupos OH presentes en las láminas positivas (4). La banda a 1370 cm-1 (v3), característica también del ion carbonato fue observada en todos los espectros y las bandas que aparecen por debajo de 1000 cm-1 son atribuidos a los enlaces metal-oxígeno (M-O-H) presentes en las láminas (4).
La banda asociada a la interacción entre las moléculas de agua y los iones carbonato (3000-3100 cm-1) fue observada únicamente en el espectro de la muestra Cu0 33Zn0 33Al0 33, lo cual puede deberse al mayor contenido de carbonato y al mayor espacio entre las láminas registrado en este sólido, como se observó a través de los valores del parámetro c. Lo anterior contribuye con el aumento del volumen en el que pueden estar ubicadas las moléculas de agua, facilitando su difusión e interacción con los carbonatos presentes.
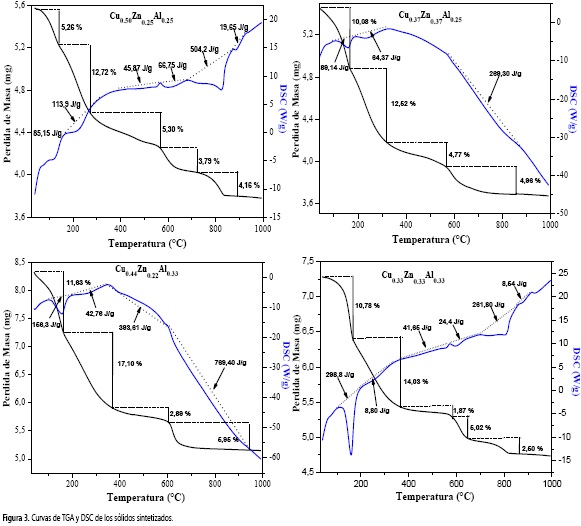
A través de los análisis de termogravimetría y calorimetría diferencial de barrido (Figura 3) se evidenció que la estructura HTLc del sólido Cu0 50Zn0 25Al0 25 es la menos estable, colapsando a 139 ° C (Tabla 1), mientras que en el caso de los otros materiales el colapso ocurrió en temperaturas más altas y próximas entre sí. Este hecho concuerda con la presencia de la fase Cu(OH)2 observada por DRX, lo cual comprueba la incidencia del efecto Jahn-Teller en la estabilidad de la estructura HTLc.
En todos los sólidos se evidenciaron varios procesos durante el calentamiento que están relacionados con la salida de agua fisisorbida en la superficie de los sólidos y la que está presente entre las láminas de la estructura. Seguido a este proceso, los aniones carbonato y grupos hidróxido se descompusieron y se formaron óxidos de cobre y zinc, a temperaturas inferiores a 350 °C, y óxidos de aluminio entre 400 y 500 °C.
En relación con el calor necesario para que ocurran los procesos característicos de la descomposición de hidrotalcitas (curva de DSC), se observa que el mayor requerimiento energético para la salida del agua antes del colapso se registra en los sólidos con mayor contenido de aluminio, lo que puede atribuirse a que este elemento forma hidróxidos con multitud de cavidades que retienen mayor cantidad de agua; esto se evidencia a través de los gráficos de TGA de los materiales. Después de la salida de moléculas de agua, ocurren reacciones de descomposición de los grupos hidróxidos y de los aniones carbonato, con el subsecuente colapso de la estructura HTLc y la formación de los óxidos metálicos. En todos los materiales se originó un segundo pico en temperaturas inferiores a 350 °C que está asociado a los procesos de descomposición ya mencionados. Posteriormente, a temperaturas mayores se observaron picos atribuidos a la formación de los óxidos de aluminio o de aluminatos.
En temperaturas superiores a 600 °C se observaron pérdidas de masa que pueden deberse a la salida de CO2, producto de la descomposición de los aniones carbonato que quedaron ocluidos en los poros de los sólidos debido al colapso de la estructura, o que pudieron haber reaccionado con los iones metálicos presentes para formar especies del tipo (Cu,Zn)AlxOy(CO3)z que también se descomponen a altas temperaturas liberando CO2 (17).
Conclusiones
El método de síntesis permitió obtener la estructura HTLc en todos los materiales, sin embargo, el aumento del contenido de cobre condujo a la formación de pequeñas cantidades de la fase Cu(OH)2 que limitan el crecimiento de las partículas de la estructura HTLc y disminuyen la estabilidad térmica de los sólidos formados. Todos los materiales presentaron señales asociadas a la presencia de las especies características de hidrotalcitas que contenían el ion carbonato. Se observó que el aumento del contenido de aluminio condujo a una mayor retención de moléculas de agua en la zona interlaminar y a una mayor interacción entre estas y los iones carbonato, así como al aumento de la estabilidad térmica de los sólidos. El efecto Jahn-Teller se evidenció a través de la formación del Cu(OH)2 en los sólidos con mayor cantidad de cobre y en el aumento de la frecuencia de vibración Cu-O-H en estos materiales. Se observó que la descomposición de la fase HTLc a bajas temperaturas conduce al encapsulamiento de aniones carbonato al interior de los sólidos, bien sea en la forma del CO2, producto de reacciones de descomposición o como especies del tipo (Cu,Zn)AlxOy(CO3)z, que pueden formarse por la reacción con los iones metálicos presentes, las cuales se descomponen en temperaturas mayores de 600 °C.
Referencias
1. Cavani, F.; Trifiro, F.; Vaccari, A. Hydrotalcite-type anionic clays: preparation, properties and application. Catal. Today 1991, 11, 173-301. DOI: https://doi.org/10.1016/0920-5861(91)80068-k.
2. Crepaldi, E.L.; Barros Valim.; J. Hidróxidos duplos lamelares: síntese, estrutura, propriedades e aplicações. Quím. Nova 1998, 21, 300-311. DOI: https://doi.org/10.1590/s0100-40421998000300011.
3. Pascale, F.; Tosoni, S.; Zicovich-Wilson, C.; Ugliengo, P.; Orlando, R.; Dovesi, R. Vibrational spectrum of brucite, Mg(OH)2: a periodic ab initio quantum mechanical calculation including OH anharmonicity. Chem. Phys. Letters 2004, 396, 308-315. DOI: https://doi.org/10.1016/j.cplett.2004.08.047.
4. Melián-Cabrera, I.; López Granados, M.; Fierro, J. L. G. Thermal decomposition of a hydrotalcite-containing Cu-Zn-Al precursor: thermal methods combined with an in situ DRIFT study. Phys. Chem. Chem. Phys. 2002, 4, 3122-3127. DOI: https://doi.org/10.1039/b201996e.
5. Goh, K.; Lim, T.; Dong, Z. Application of layered double hydroxides for removal of oxyânions: A review. Water Res. 2008, 42, 1343-13686 DOI: https://doi.org/10.1016/j.watres.2007.10.043.
6. Jiang, L.; Ye, Binghuo; Wei, Kemei. Effects of CeO2 on structure and properties of Ni-Mn-K/bauxite catalysts for water-gas shift reaction. J. Rare Earth, 2008, 26, 352-356. DOI: https://doi.org/10.1016/s1002-0721(08)60094-0.
7. Meza-Fuentes, E.; Costa Faro, A.; Freitas Silva, T.; Mansur. Assaf. J.; Rangel. M. A comparison between copper and nickel-based catalysts obtained from hydrotalcite-like precursors for WGSR. Catal. Today, 2011, 171, 290-296. DOI: https://doi.org/10.1016/j.cattod.2011.03.082.
8. Iglesias, A. H.; Ferreira, O. P.; Gouveiab, D. X.; Souza Filho, A. G.; de Paiva, J.A.C.; Mendes Filho, J.; Alves, O. L. Structural and thermal properties of Co-Cu-Fe hydrotalcite-like compounds. J. Solid. State. Chem, 2005, 178, 142-152. DOI: https://doi.org/10.1016/j.jssc.2004.10.039.
9. Newman, S. P.; Jones, W. Synthesis, characterization and applications of layered double hydroxides containing organic guests New J. Chem, 1998, 22, 105-115. DOI: https://doi.org/10.1039/a708319j.
10. Gupta S.; Agarwal, D.; Banerjee, S. Thermal stabilization of poly (vinyl chloride) by hydrotalcites, zeolites, and conventional stabilizers. J. Vinyl. Addit. Techn. 2009, 15, 164-170. DOI: https://doi.org/10.1002/vnl.20196.
11. Touahra, F.; Sehailia, M.; Ketir, W.; Bachari, K.. ; Chebout, R.; Trari, M.; Cherifi, O.; Halliche, D. Effect of the Ni/Al ratio of hydrotalcite-type catalysts on their performance in the methane dry reforming process. Applied Petrochem Res. 2016, 6, 1-13. DOI: https://doi.org/10.1007/s13203-015-0109-y
12. Debek, R.; Motak, M.; Duraczynska, D.; Launay, F.; Galvez, M.; Grzybek, T.; Da Costa, P. Methane dry reforming over hydrotalcite-derived Ni-Mg-Al mixed oxides: The Influence of Ni content on catalytic activity, selectivity and stability. Catal. Sci. Technol, 2016, 6 (17), 6705-6715. DOI: https://doi.org/10.1039/c6cy00906a.
13. Espinal, R.; Taboada, E.; Molins, E.; Chimentao R.; Medina, F.; Llorca, J. Ethanol Steam Reforming Over Hydrotalcite-Derived Co Catalysts Doped with Pt and Rh. Topics in Catal. 2013, 56 (18), 1660-1671. DOI: https://doi.org/10.1007/s11244-013-0100-8.
14. Meza Fuentes, E.; Cadete Santos Aires, F. J.; Prakash, S.; da Costa Faro, A.; de Freitas Silva, T.; Mansur Assaf J.; Rangel M. The effect of metal content on nickel-based catalysts obtained from hydrotalcites for WGSR in one step Inter. J. Hydrogen Energy 2014, 39, 1-14. DOI: https://doi.org/10.1016/j.ijhydene.2013.10.114.
15. Costantino, U.; Marmottini, F.; Sisani, M.; Montanari, T.; Ramis, G.; Busca, G.; Turco, M.; Bagnasco, G. Cu-Zn-Al hydrotalcites as precursors of catalysts for the production of hydrogen from methanol. Solid State Ionics 2005, 176, 2917-2922. DOI: https://doi.org/10.1016/j.ssi.2005.09.051.
16. Wang, X.; Andrews, L. Infrared spectra of M(OH)1,2,3 (M = Mn, Fe, Co, Ni) molecules in solid argon and the character of first row transition metal hydroxide bonding. J. Phys. Chem. A, 2006, 110, 10035-10045. DOI: https://doi.org/10.1021/jp0624698
17. Kannan, S.; Rives, V.; Knözinger, H. High-temperature transformations of Cu-rich hydrotalcites. J. Solid. State. Chem. 2004,177, 319-331. DOI: https://doi.org/10.1016/j.jssc.2003.08.023.
Referencias
Cavani, F.; Trifiro, F.; Vaccari, A. Hydrotalcite-type ânionic clays: preparation, properties and application. Catal. Today 1991, 11, 173-301. DOI: https://doi.org/10.1016/0920-5861(91)80068-k.
Crepaldi, E.L.; Barros Valim.; J. Hidróxidos duplos lamelares: síntese, estrutura, propriedades e aplicações. Quím. Nova, 1998, 21, 300-311. DOI: https://doi.org/10.1590/s0100-40421998000300011.
Pascale, F.; Tosoni, S.; Zicovich-Wilson, C.; Ugliengo, P.; Orlando, R.; Dovesi, R. Vibrational spectrum of brucite, Mg(OH)2: a periodic ab initio quantum mechanical calculation including OH anharmonicity. Chem. Phys. Letters, 2004, 396, 308-315. DOI: http://dx.doi.org/10.1016/j.cplett.2004.08.047.
Melián-Cabrera, I.; López Granados, M.; Fierro, J. L. G. Thermal decomposition of a hydrotalcite-containing Cu–Zn–Al precursor: thermal methods combined with an in situ DRIFT study. Phys. Chem. Chem. Phys. 2002, 4, 3122-3127. DOI: https://doi.org/10.1039/b201996e.
Goh, K.; Lim, T.; Dong, Z. Application of layered double hydroxides for removal of oxyânions: A review. Water Res. 2008, 42, 1343-1368. DOI: https://doi.org/10.1016/j.watres.2007.10.043.
JIANG, L.; Ye, Binghuo; Wei, Kemei. Effects of CeO2 on structure and properties of Ni-Mn-K/bauxite catalysts for water-gas shift reaction. J. Rare Earth, 2008, 26, 352-356. DOI: https://doi.org/10.1016/s1002-0721(08)60094-0.
Meza-Fuentes, E.; Costa Faro, A.; Freitas Silva, T.; Mansur. Assaf. J.; Rangel. M. A comparison between copper and nickel-based catalysts obtained from hydrotalcite-like precursors for WGSR. Catal. Today, 2011, 171, 290-296. DOI: https://doi.org/10.1016/j.cattod.2011.03.082.
Iglesias, A. H.; Ferreira, O. P.; Gouveiab, D. X.; Souza Filho, A. G.; de Paiva, J.A.C.; Mendes Filho, J.; Alves, O. L. Structural and thermal properties of Co–Cu–Fe hydrotalcite-like compounds. J. Solid. State. Chem, 2005, 178, 142-152. DOI: http://dx.doi.org/10.1016/j.jssc.2004.10.039.
Newman, S. P.; Jones, W. Synthesis, characterization and applications of layered double hydroxides containing organic guests. New J. Chem, 1998, 22, 105-115. DOI: https://doi.org/10.1039/a708319j.
Gupta S.; Agarwal, D.; Banerjee, S. Thermal stabilization of poly(vinyl chloride) by hydrotalcites, zeolites, and conventional stabilizers. J. Vinyl. Addit. Techn 15, 164-170, 2009. DOI: https://doi.org/10.1002/vnl.20196.
Touahra, F.; Sehailia, M.; Ketir, W.; Bachari, K..; Chebout, R.; Trari, M.; Cherifi, O.; Halliche, D. Effect of the Ni/Al ratio of hydrotalcite-type catalysts on their performance in the methane dry reforming process. Applied Petrochem Res, 2016, 6, 1–13. DOI: http://dx.doi.org/10.1007/s13203-015-0109-y.
Dębek, R.; Motak, M.; Duraczynska, D.; Launay, F.; Galvez, M.; Grzybek, T.; Da Costa, P. Methane dry reforming over hydrotalcite-derived Ni-Mg-Al mixed oxides: The Influence of Ni content on catalytic activity, selectivity and stability. Catal. Sci. Technol, 2016, 6 (17), 6705-6715. DOI: http://dx.doi.org/10.1039/c6cy00906a.
Espinal, R.; Taboada, E.; Molins, E.; Chimentao R.; Medina, F.; Llorca, J. Ethanol Steam Reforming Over Hydrotalcite-Derived Co Catalysts Doped with Pt and Rh. Topics in Catal. 2013, 56, 18, 1660-1671. DOI: https://doi.org/10.1007/s11244-013-0100-8.
Meza Fuentes E.; Cadete Santos Aires F.J.; Prakash S.; da Costa Faro A.; de Freitas Silva T.; Mansur Assaf J.; Rangel M. The effect of metal content on nickel-based catalysts obtained from hydrotalcites for WGSR in one step. Inter. J. Hydrogen Energy. 2014, 39, 1-14. DOI: https://doi.org/10.1016/j.ijhydene.2013.10.114
Costantino, U.; Marmottini, F.; Sisani, M.; Montanari, T.; Ramis, G.; Busca, G.; Turco, M.; Bagnasco, G. Cu–Zn–Al hydrotalcites as precursors of catalysts for the production of hydrogen from methanol. Solid State Ionics, 2005, 176, 2917-2922. DOI: http://dx.doi.org/10.1016/j.ssi.2005.09.051.
Wang, X.; Andrews, L. Infrared spectra of M(OH)1,2,3 (M=Mn, Fe, Co, Ni) molecules in solid argon and the character of first row transition metal hydroxide bonding. J. Phys. Chem. A, 2006, 110, 10035-10045. DOI: http://dx.doi.org/10.1021/jp0624698
Kannan, S.; Rives, V.; Knözinger, H. High-temperature transformations of Cu-rich hydrotalcites. J. Solid. State. Chem, 2004, 177, 319-331. DOI: https://doi.org/10.1016/j.jssc.2003.08.023.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. E. Meza-Fuentes, J. Rodriguez-Ruiz, C. Solano-Polo, M.C. Rangel, A. Faro. (2020). Monitoring the structural and textural changes of Ni-Zn-Al hydrotalcites under heating. Thermochimica Acta, 687, p.178594. https://doi.org/10.1016/j.tca.2020.178594.
2. Edgardo Meza Fuentes, Johana Ines Rodriguez Ruiz, Maria do Carmo Rangel Santos. (2019). Characteristics of NiO present in solids obtained from hydrotalcites based on Ni/Al and Ni-Zn/Al. DYNA, 86(210), p.58. https://doi.org/10.15446/dyna.v86n210.78559.
3. Hadja Alia Tabti, Mehdi Adjdir, Abdelkader Ammam, Baghdad Mdjahed, Brahim Guezzen, Amina Ramdani, Choukry Kamel Benddedouche, Noria Bouchikhi, Nadir Chami. (2020). Facile synthesis of Cu-LDH with different Cu/Al molar ratios: application as antibacterial inhibitors. Research on Chemical Intermediates, 46(12), p.5377. https://doi.org/10.1007/s11164-020-04268-8.
4. Ilich Rios Leon, Cesar Solano Polo, Johana Rodriguez Ruiz, Eduardo Espinosa Fuentes, Edgardo Meza Fuentes. (2017). Estudio a través de espectroscopia infrarroja y termogravimetría del efecto de la temperatura en hidrotalcitas de níquel y aluminio. DYNA, 84(201), p.9. https://doi.org/10.15446/dyna.v84n201.59768.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).